今日,美国FDA宣布,批准辉瑞(Pfizer)公司的抗癌新药Talzenna(talazoparib)上市,用以治疗携带生殖系BRCA突变(有害或怀疑有害),HER2阴性的局部晚期或转移性乳腺癌患者。 Talazoparib是迄今为止,FDA批准的第4款PARP抑制剂。

大家可以关注公众号”三阴姐妹互助圈“下载三阴乳腺癌的治疗资料包和添加病友群,请扫下面的二维码。

 PARP抑制剂是一种靶向聚ADP核糖聚合酶(Poly ADP-ribose Polymerase,PARP)的癌症疗法。聚腺苷二磷酸核糖聚合酶(PARP)是一种DNA修复酶,在DNA修复通路中起关键作用。
DNA损伤断裂时会激活PARP,它作为DNA损伤的一种分子感受器,具有识别、结合到DNA断裂位置的功能,进而激活、催化受体蛋白的聚ADP核糖基化作用,参与DNA的修复过程。
研究发现携带BRCA突变的肿瘤细胞对PARP抑制剂的敏感度高。
在Talzenna(talazoparib)之前,已有三款PARP抑制剂获批。分别是奥拉帕尼(Olaparib)、卢卡帕尼(Rucaparib)和尼拉帕尼(Niraparib)。
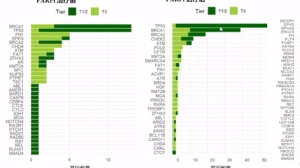
Talzenna(talazoparib)获批是基于EMBRACA的3期临床试验的结果。在这项研究中,431名患者以2:1的比例接受talazoparib或化疗。所有患者携带生殖系BRCA突变。
试验结果表明,接受talazoparib治疗的患者相比接受化疗的患者,无进展生存期(PFS)显著延长,Talazoparib组中位PFS为8.6个月,化疗组中位PFS为5.6个月(HR 0.54, 95% CI: 0.41, 0.71; p<0.0001)。Talazoparib将疾病进展风险降低了46%。另外Talazoparib组的客观缓解率为62.6%,是化疗组(27.2%)的两倍以上(p<0.0001)。
参考资料:
[1] FDA approves talazoparib for gBRCAm HER2-negative locally advanced or metastatic breast cancer. Retrieved October 16, 2018,
[2] https://press.pfizer.com/press-release/talazoparib-significantly-extends-progression-free-survival-phase-3-embraca-trial-pati
PARP抑制剂是一种靶向聚ADP核糖聚合酶(Poly ADP-ribose Polymerase,PARP)的癌症疗法。聚腺苷二磷酸核糖聚合酶(PARP)是一种DNA修复酶,在DNA修复通路中起关键作用。
DNA损伤断裂时会激活PARP,它作为DNA损伤的一种分子感受器,具有识别、结合到DNA断裂位置的功能,进而激活、催化受体蛋白的聚ADP核糖基化作用,参与DNA的修复过程。
研究发现携带BRCA突变的肿瘤细胞对PARP抑制剂的敏感度高。
在Talzenna(talazoparib)之前,已有三款PARP抑制剂获批。分别是奥拉帕尼(Olaparib)、卢卡帕尼(Rucaparib)和尼拉帕尼(Niraparib)。
Talzenna(talazoparib)获批是基于EMBRACA的3期临床试验的结果。在这项研究中,431名患者以2:1的比例接受talazoparib或化疗。所有患者携带生殖系BRCA突变。
试验结果表明,接受talazoparib治疗的患者相比接受化疗的患者,无进展生存期(PFS)显著延长,Talazoparib组中位PFS为8.6个月,化疗组中位PFS为5.6个月(HR 0.54, 95% CI: 0.41, 0.71; p<0.0001)。Talazoparib将疾病进展风险降低了46%。另外Talazoparib组的客观缓解率为62.6%,是化疗组(27.2%)的两倍以上(p<0.0001)。
参考资料:
[1] FDA approves talazoparib for gBRCAm HER2-negative locally advanced or metastatic breast cancer. Retrieved October 16, 2018,
[2] https://press.pfizer.com/press-release/talazoparib-significantly-extends-progression-free-survival-phase-3-embraca-trial-pati
本文仅供医学药学专业人士阅读





.jpg-pd13)


-scaled.jpg-pd13)















 X
X