三阴性乳腺癌(TNBC)约占所有乳腺癌病例的15%,顾名思义,TNBC患者缺乏雌激素受体(ER)和孕激素受体(PR)表达,以及缺乏或只有低水平的人表皮生长因子受体-2(HER-2)表达。与其他类型乳腺癌相比,TNBC不仅更容易扩散转移和复发,而且缺乏治疗靶点,因此患者预后较差,名副其实的“最恶”乳腺癌。
早期三阴性乳腺癌的标准疗法是化疗,近年来免疫疗法,如PD-(L)1抑制剂等,进展让人寄予厚望,但离攻克TNBC仍任重道远。
上周,发表在《自然》子刊Nature Medicine的一项溶瘤病毒2期临床试验结果显示,手术前接受溶瘤病毒与化疗的组合治疗后,更多TNBC患者手术切除组织中的癌细胞消失,且近90%患者在手术进行后的两年没有疾病复发!到底是怎么回事?我们今天一起来看~
89%患者2年未复发!
今日的主人公——talimogene laherparepvec(T-VEC)是首个获FDA批准的首个溶瘤病毒疗法,该疗法于2015年获批用于治疗晚期黑色素瘤。为什么会大步跨界TNBC呢?
既往试验发现,当TNBC患者肿瘤内含有较多浸润的淋巴细胞时,患者对于化疗作为新辅助疗法的应答性较好。由于溶瘤病毒具有募集免疫细胞至肿瘤的能力,因此研究人员便思考是否化疗与溶瘤病毒疗法组合可以改善TNBC患者的治疗。
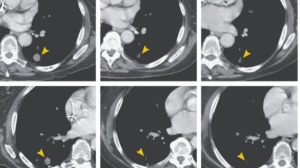
这项试验中最终纳入37位II、III期的TNBC患者,在接受手术移除肿瘤之前,他们皆进行长达12周的化疗,并在同时接受了数次T-VEC病毒注射至其肿瘤内。研究人员在第6周时采集病患肿瘤活检组织并在手术后取下其肿瘤进行分析。所有患者在手术完成后持续接受标准疗法治疗。
大家可以关注公众号”三阴姐妹互助圈“下载三阴乳腺癌的治疗资料包和添加病友群,请扫下面的二维码。

当研究人员对活检组织进行分析时发现,有许多杀伤T细胞浸润至肿瘤内,这是T-VEC病毒作用的标志。此外,有45.9%接受T-VEC与化疗组合疗法的患者在完成治疗时,其肿瘤中没有发现活的癌细胞。这项数值在过去仅接受化疗的患者身上仅约15-30%。而有达89%接受组合疗法的患者,在两年后没有疾病复发。而以往仅接受化疗新辅助治疗的患者这一数值只有60%。现今TNBC的标准疗法是化疗与PD-1抑制剂帕博利珠单抗(K药)构成的组合疗法,接受此疗法TNBC患者的三年无复发率约为84%。
换言之,如果试验中患者的无复发率能够维持的话,这项溶瘤病毒组合疗法将可媲美现今的帕博利珠单抗标准疗法!
另外,研究人员还分析了免疫生物标志物与患者疗效的联系。结果显示,在治疗的前6周,大多数肿瘤样本具有更高水平的抗肿瘤T细胞和免疫信号通路的激活。对治疗反应更好的患者在第6周的CD8 T细胞水平高于对疗效不佳的患者。这些观察结果表明,更早地激活免疫反应可能会为TNBC患者带来更好的结果。
这项试验展现了溶瘤病毒疗法在TNBC治疗上的巨大潜力。且这项试验启动于在K药尚未成为TNBC标准疗法之时,因此研究人员并未K药纳入试验设计。由于溶瘤病毒激发患者产生抗肿瘤免疫反应的机制与K药迥异,因此这两类免疫疗法的合并将可能产生协同作用,进而更有效地治疗患者。
受限于实验设计,因此结果仍需通过大型的随机试验进行进一步的验证。这个但免疫疗法新方向显然令人期待~
“以毒攻毒”?关于溶瘤病毒疗法
溶瘤病毒疗法打击肿瘤的直接手段,便是通过感染癌细胞后在里面进行大量复制,导致癌细胞破裂死亡。这种抗肿瘤方式对于健康细胞的影响不大,这是因为健康细胞具有正常的抗病毒抵御机制,因此可以通过启动干扰素(IFN)反应来对抗病毒。癌细胞通常缺乏这种机制,因此病毒能够在其中无限制地繁殖。而科学家也刻意对构成T-VEC的1型单纯疱疹病毒(HSV)进行修饰,使其对干扰素的作用更为敏感,以此来降低对健康细胞的影响。
除了直接攻击癌细胞外,T-VEC病毒也能刺激患者体内的免疫系统对抗肿瘤。当T-VEC病毒在癌细胞内复制时,会同时表达粒细胞-巨噬细胞集落刺激因子(GM-CSF)。这种蛋白会随着癌细胞最终的破裂而被释放至肿瘤微环境中,进而刺激临近的免疫细胞聚集并活化攻击癌细胞。而随着癌细胞的破裂,各种肿瘤蛋白也随之被释放,免疫系统也因此能够辨认许多肿瘤相关抗原并对其产生记忆,从而可能避免未来癌症的复发。
参考文献:
1.https://medicalxpress.com/news/2023-02-oncolytic-virus-treatment-results-patients.html
2.https://www.nature.com/articles/s41591-023-02210-0
本文仅供医学药学专业人士阅读








-scaled.jpg-pd13)















 X
X