2019 年 3 月,FDA正式批准阿替利珠单抗(Tecentriq)联合白蛋白结合型紫杉醇用于肿瘤表达 PD-L1 阳性的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者。但是,迄今为止,尚未报道过免疫治疗在PD-L1阴性TNBC中的疗效。在这里,我们介绍了一名患有 TNBC 且肿瘤浸润淋巴细胞低且 PD-L1 阴性疾病的女性的案例研究,患者对T药单药以及化免联合方案取得了显著而持久的临床反应。让我们一起来看看吧~
初始诊断为ER+/HER2+乳腺癌
一名 44 岁的西班牙白人女性没有明显的家族史或遗传史,最初于 2008 年被诊断出患有左侧乳腺癌 (pT2N3M0)。病理报告显示 ER+、PR -和 HER2+ 乳腺浸润性癌。她于 2008 年 10 月接受了手术,并接受了基于抗 HER2 的辅助化疗,随后进行了局部放疗和内分泌治疗。
十年后,转变成ER+/HER2-乳腺癌
伴随骨转移
2018年4月,患者经超声诊断为右侧锁骨上和腋窝阳性淋巴结(17mm和3mm)。通过 PET/CT 扫描检测到骨转移。对右侧锁骨上淋巴结进行了核心活检,结果显示 ER+ 和 HER2 -浸润性小叶癌。在该肿瘤活检中,基于扩增子的泛癌基因 DNA 测序面板显示存在PIK3CA E545K(18% 突变等位基因频率 [MAF])和 726F(16% MAF)体细胞突变。作为一线治疗,她接受了氟维司群和哌柏西利(每天 125 毫克,服用 3 周,停药 1 周)直到 2019 年 5 月(治疗 13 个月),观察到骨骼和淋巴结进展。
病情再次进展为TNBC小叶癌,
化免联合方案起效
医生对患者右侧乳房和腋窝淋巴结又进行了两次新的活检,发现 TNBC 小叶癌。在乳腺病变中,肿瘤的 Ki67 为 18%,TIL 低于 1%,并且通过免疫组织化学(Ventana PD-L1 抗体克隆 SP142)为 PD-L1 阴性。PAM50/Prosigna ® 的固有亚型揭示了一种富含 HER2 的亚型,其ERBB2 mRNA水平较低。431 个基因的 DNA 测序面板显示PIK3CA E545K 和TP53 Q331* 突变、每兆碱基 38.5 个突变 (mut/Mb) 的高 TMB 和 APOBEC 突变谱,包括特征 S2 和 S13。Guardant360 74-gene panel 证实存在多个体细胞突变,包括PIK3CA E545K 突变,变异等位基因比例为 12.2%。
大家可以关注公众号”三阴姐妹互助圈“下载三阴乳腺癌的治疗资料包和添加病友群,请扫下面的二维码。

基于这些结果,专家们在巴塞罗那医院诊所的每周多学科肿瘤委员会上讨论了该临床病例。由于已经报道了具有高TMB的乳腺癌患者的免疫治疗活性,因此专家计划了单药免疫联合化疗的治疗方案。更具体地说,在 2019 年 7 月,患者接受了一剂 1200 mg T药单药治疗,3 周后继续接受 1200 mg T药(第 1 天)加上每周 100 mg/m 2白蛋白结合型紫杉醇。2021 年 8 月(治疗 24 个月),患者继续接受治疗,表现出持久的部分反应和良好的体能状态。

图 1患者治疗时间表和 DNA 改变。
(A)患者治疗时间表。(B)使用 VHIO-300 面板确定的 T1(2008 年样本)、T2(2018 年样本)和 T2-PD(2019 年样本)中的突变等位基因频率 (MAF;%)。分类为致病性或可能致病性的变体以粗体突出显示;与 APOBEC DNA 序列特征匹配的变体标有下划线。(C)使用 VHIO-300 面板和全外显子组测序 (WES) 在 T1、T2 和 T2-PD 之间重叠体细胞突变。(D) TMB 使用 VHIO-300 面板和 WES 表示为 T1、T2 和 T2-PD 中的突变/兆碱基。(五)年龄、APOBEC 缺陷 (APOBEC)、错配修复缺陷/微卫星不稳定性 (dMMR/MSI) 的 COSMIC 突变特征反映为小插入和缺失 (INDEL)、紫外线 (UV)、聚合酶 E 缺陷 (POLE) 和黄曲霉毒素效应T1、T2 和 T2-PD 由 WES 确定。(F) WES 确定的 T1、T2 和 T2-PD 中 APOBEC 相关突变和其他突变的 MAF 分布。
由于 ctDNA 可以替代治疗反应和长期结果,因此在T药使用之前、T药单药治疗 3 周后和 T药加白蛋白结合型紫杉醇 3 周后收集了液体活检。使用标准化的 Guardant360 测定法对血浆样品进行测序。在免疫治疗前的血浆样本中发现了 37 个基因的突变,最高变异等位基因频率 (VAF) 为 12.2%。T药单药治疗后,唯一可检测到的突变是PDGFRA D691E(VAF = 0.1%)。T药加白蛋白结合型紫杉醇 1 个月后,检测到的唯一突变是ALK R1061Q(VAF = 0.5%)(图 2B)。2 个月后,胸部 CT 扫描证实胸壁软组织和乳腺淋巴结出现部分缓解(PR),2020 年 12 月,患者继续获得临床和放射学缓解(图 2C)。骨转移每3个月随访一次CT,病情稳定为最佳反应。

图 2基因表达以及对 atezolizumab 和白蛋白结合型紫杉醇的分子和临床反应。
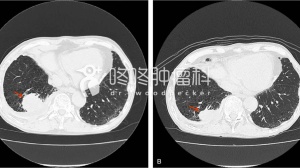
(A)轮图描绘了使用基于乳腺癌 360 nCounter 的基因表达面板确定的 T2 和 T2-PD 样本的每个特征的相对表达。签名根据它们所属的生物过程进行分组。Luminal A、Luminal B、富含 HER2 和基底样亚型相关性评分显示为径向弧。签名分数(0-16,从低到高)表示为径向投影。(二)Guardant360 肿瘤反应图显示了使用 Guardant360 结果在 ctDNA 中评估的最高变异等位基因分数 (%) 和 MAF (%),治疗前、阿特珠单抗单药治疗 3 周后以及阿特珠单抗和白蛋白结合型紫杉醇组合后。(C) CT 扫描。红色箭头表示治疗期间胸壁软组织(顶部)和乳腺结节(中间)和骨骼(底部)的病变。
总结
这位患者被诊断为 ER+/HER2- 转移性乳腺癌后,进行了结合 CDK4/6 抑制剂的一线内分泌治疗,再次疾病进展并且失去了 ER 表达并成为 TNBC患者;患者为 PD-L1 阴性并且最终受益于T药与白蛋白结合型紫杉醇的组合。该案例告诉我们获得基因组改变和基因表达谱的变化可能会导致治疗失败和疾病进展;尽管仍无法确定患者对单独使用T药或与白蛋白结合型紫杉醇联合治疗产生反应的主要原因,但所进行的广泛分子表征可以提供与 PD-L1 阴性 TNBC 免疫治疗获益相关特征的线索,也给今后的免疫治疗提供了更多的方向。
参考资料:
https://www.frontiersin.org/articles/10.3389/fonc.2021.710596/full
本文仅供医学药学专业人士阅读







-scaled.jpg-pd13)















 X
X