近年来ADC药物兴起,尤其是在乳腺癌领域发展迅猛,众多国内外药企纷纷布局。小编盘点了目前进度比较领先的14款ADC产品,供各位读者参考~
“抗癌神药”ADC
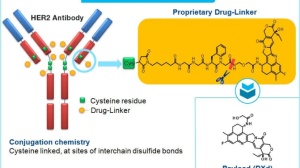
前面说了这么多,可能还有患者不太理解什么是ADC药物。ADC,即抗体药物偶联物,就是将靶向特定抗原的抗体(mAb),通过连接子(linker)与药物载荷-细胞毒小分子(payload)连接在一起。ADC药物依靠抗体的特定靶向性到达肿瘤细胞,再通过内吞作用进入到细胞,在低pH值或溶酶体蛋白的作用下linker断裂,释放出细胞毒小分子,从而发挥对肿瘤细胞的杀伤作用。

1
首个ADC药物——T-DM1
2013年,FDA批准Trastuzumab Emtansine Kadcyla(T-DM1,赫赛莱)上市,用于治疗HER2阳性的转移性乳腺癌患者,成为全球首个获批的单药治疗实体瘤的抗体药物偶联物。2020年1月,罗氏制药宣布,国家药品监督管理总局正式批准创新靶向药物赫赛用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。也是中国第一个HER2靶向与化疗偶联的ADC产品。
T-DM1由曲妥珠单抗、强效的毒素小分子DM1(美坦辛衍生物)通过硫醚连接体偶联而成。T-DM1机制独特,具有靶向、强效以及稳定的特点。
让T-DM1一炮而红的著名的KATHERINE研究是一项国际多中心Ⅲ期临床研究,共计纳入1486例采用含曲妥珠单抗方案进行新辅助治疗后non-pCR的HER2阳性乳腺癌患者,这部分患者有多数单独应用曲妥珠单抗,少部分患者应用曲妥珠单抗+帕妥珠单抗。入组患者1:1随机入组,分别接受T-DM1或曲妥珠单抗治疗。研究的主要终点是iDFS。全球ITT人群中,两组3年iDFS分别为88.3%和77.0%,绝对差异为11.3%,T-DM1组疾病复发、死亡风险较曲妥珠单抗组降低50%(HR 0.50;95%CI 0.39 ~ 0.64;P < 0.001 )。

但是二代ADC药物的出现——DS8201给TDM1带来了不小的冲击。
DESTINY-Breast03研究是首个头对头对比ADC药物(DS8201和T-DM1)治疗HER2阳性晚期乳腺癌疗效与安全性的一项多中心、开放性、随机、Ⅲ期临床研究,纳入了先前在晚期或转移性环境中接受过曲妥珠单抗(赫赛汀)和紫杉类治疗的不可切除或转移性 HER2 阳性乳腺癌患者。值得注意的是,这些患者被允许具有临床稳定的、经治疗的脑转移。
共有 524 名参与者以 1:1 的比例随机接受每 3 周 5.4 mg/kg 的DS8201(n = 261)或每 3 周 3.6 mg/kg 的 T-DM1(n = 263)。DS8201的中位随访时间为 16.2 个月,T-DM1 的中位随访时间为 15.3 个月。在所有治疗组中,参与者的中位年龄为 54.3 岁,99.6% 是女性,大多数来自亚洲,并且每个免疫组织化学的 HER2 状态为 3+。此外,研究组 59.0% 和对照组 66.5% 的 ECOG 体能状态为 0,分别有 50.2% 和 51.0% 的患者激素受体呈阳性。DS8201 组23.8% 的患者有脑转移,而 T-DM1 组的患者为 19.8%;分别有 70.5% 和 70.3% 有内脏疾病。
在 2021 年 ESMO 大会期间提交的试验数据显示,研究者评估的DS8201的PFS为 25.1 个月(95% CI,22.1–NE),而 T-DM1 为 7.2 个月(95% CI,6.8-8.3)(HR,0.27);研究组或对照组均未达到中位 OS(HR,0.56;95% CI,0.36-0.86;P = .007172)。DS8201对比TDM1降低HER2阳性转移性乳腺癌患者进展或死亡风险72% !(95% CI,0.20-0.35;P = 6.5 x 10 -24)

此外,DS8201确认的ORR为 79.7%(95% CI,74.3%-84.4%),而 T-DM1 为 34.2%(95% CI,28.5%-40.3%)(P < .0001)。在对DS8201有反应的患者中,16.1% 达到完全反应,63.6% 达到部分反应,16.9% 病情稳定,1.1% 出现疾病进展。调查组和对照组的疾病控制率分别为 96.6% 和 76.8%。

此次研究或将改变HER2阳性乳腺癌二线标准治疗的格局。头对头试验的败北,给了TDM1当头一棒。
2
DS8201靶向四大癌种,尽显神药本色
2019年12月21日,基于DESTINY-Breast01研究,FDA正式批准DS-8201用于HER2阳性乳腺癌的后线治疗。
大家可以关注公众号”三阴姐妹互助圈“下载三阴乳腺癌的治疗资料包和添加病友群,请扫下面的二维码。

2020年5月18日,阿斯利康和第一三共联合宣布,双方共同开发的DS-8201获得美国FDA授予的突破性疗法(BTD)认定,用于治疗HER2突变的铂类治疗中或治疗后疾病进展的转移性非小细胞肺癌(NSCLC)患者。
2021年1月15日,FDA批准DS-8201扩展适用范围,用于经曲妥珠单抗治疗的HER2阳性局部晚期或转移性胃癌和胃食管结合部(GEJ)腺癌患者。
乳腺癌的批准是基于著名的DESTINY-Breast01 2期试验,DESTINY-Breast01是一项单臂、开放标签、全球多中心研究,评估了DS8201(5.4mg/kg)作为单药疗法治疗HER2阳性、不可切除性和/或转移性乳腺癌患者安全性和有效性。该研究共入组了全球100多个临床地点的184例患者,这些患者先前已接受过2种或多种HER2靶向方案,治疗转移性疾病的既往疗法中位数为6。研究主要终点是总缓解率(ORR)。
在2021 ESMO大会上更新了最新研究结果:截至2021年3月26日,中位OS随访时间为31.1个月(95% Cl:30.7~32.0),更新的中位OS为29.1个月(95% Cl:24.6~36.1)。随着数据的进一步成熟,超过一半的患者有OS事件发生(95/184,51.6%)(Figure 2)。估计12个月的OS为85%(95% Cl:79~90),估计18个月的OS为75% (95% Cl:67~80),估计24个月的OS为58%(95% Cl:51~65)。

2020SABCS大会上公布的数据显示,中位DoR为20.8 个月;mPFS为19.4 个月(95%CI,14.1 mo-NE);确认的ORR为61.4%(其中有12个CR),DCR为97.3%(95%CI,93.8-99.1);

DS8201的安全性与先前报道的相似。
3
IMMU132拿下最难三阴乳腺癌
Trop-2是一种跨膜糖蛋白,在各种人类上皮癌中更是高度表达,这使得TROP2成为一个理想的治疗靶点。2020年4月22日,Trop-2 ADC药物Sacituzumab Govitecan (Trodelvy,IMMU-132)获得FDA加速批准,用于三线及以上转移性三阴乳腺癌,成为首个上市的Trop-2靶向药物。
该获批是基于ASCENT研究,IMMU-132在三阴乳癌后线临床研究结果,以33.3%的三线有效率,直接绿灯通行,成功上市。TROP2靶点的药物在各癌种数据中也相继报道,泛癌种治疗趋势逐渐成型!
该研究中接受IMMU-132治疗的患者组ORR高达33.3%,远高于传统的化疗组疗效。中位PFS是5.5个月,中位OS为13个月。


4
国产新星ARX788 DCR高达100%!
ARX788是由安博生物和浙江医药共同研制的ADC药物。在2020CSCO大会上,复旦大学附属肿瘤医院胡夕春教授,介绍了ARX788在HER2阳性晚期乳腺癌患者中的安全性和有效性的研究。与TDM1相比,ARX788的工艺控制、药物稳定性和体内代谢等方面均具有很好的优势。
研究共入组59例HER2阳性晚期乳腺癌患者,94.9%的患者为HER2阳性,5.1%的患者为HER2低表达,所有患者均经历过曲妥珠单抗治疗。
疗效方面,从疗效瀑布图可见,大部分患者均得到显著改善,高剂量组患者疗效更好。也就是说,随着剂量的递增,ORR更好,1.5mg/kg组的ORR达到了68.4%,DCR100%,无DLT发生。既往使用过TKI治疗的患者ORR也达到了44.7%。


不良反应方面,在59名受试者中,仅出现了7例与药物相关的≥3级不良反应。
ARX788展现了巨大的潜力。虽然不同于DS-8201针对T-DM1等治疗失败的患者,但ARX788对曲妥珠单抗和拉帕替尼治疗失败的患者都表现出很高的响应率,1.5 mg/kg组DCR更是高达100%,且安全性较好。ARX788治疗HER2阳性乳腺癌的II/III期研究正在进行中,静候佳音。
5
荣昌RC48靶向实体瘤,进展迅猛
2020年4月26日,荣昌生物官方微信宣布,公司自主研发的ADC新药RC48(disitamabvedotin,商品名:爱地希)已获得FDA审批,获准在美国直接进行Ⅱ期临床试验,适应证为HER2阳性局部晚期或转移性尿路上皮癌。荣昌生物自主研发的RC48是我国第一个进入临床研究的抗体偶联(ADC)药物。
在今年6月9日,中国国家药监局(NMPA)也正式宣布荣昌生物注射用维迪西妥单抗(商品名:爱地希)上市,用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。
目前,RC48在乳腺癌等多个实体癌治疗的临床试验也正在迅速推进中。
还有众多国内外药企ADC布局乳腺癌,目前进展如下:

期待更多的ADC药物成功上市,为患者带来更多的临床获益!
本文仅供医学药学专业人士阅读






.jpg-pd13)
-scaled.jpg-pd13)















 X
X