听说有些新人刚进群,刚知道PD-1,或者对PD-1一知半解,担心专家讲得太专业,听不懂?
没关系,黎主任为大家贴心准备了学习资料,缺乏相关背景知识也不怕。看了这一篇,相信您对PD-1在肝癌临床上的应用和PD-1的联合治疗都会有一个初步的了解,有了知识储备,今晚就能从容听课了。
赶紧学起来吧。
1、有关PD-1在肝癌临床的应用问题
2017年9月23日,美国食品药品监督管理局(FDA)批准了Nivolumab用于接受过索拉非尼治疗后的肝细胞癌患者,标志着肝癌的免疫治疗时代正式来临。
⑴已开展的I/II期临床研究结果
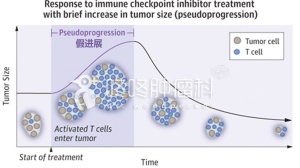
在2015年ASCO会议上,相关研究人员公布了PD-1抗体Nivolumab治疗晚期HCC的I/II期临床结果。剂量递增实验表明,Nivolumab对于HCV、HBV感染者的安全剂量为3mg/kg。对于无肝炎病毒感染者,安全剂量为10mg/kg。该研究以47例晚期HCC患者作为研究对象,70%有肝外转移,13%有血管侵犯,68%有Sorafenib治疗史,截至中期分析节点,17例仍接受Nivolumab治疗,26例因疾病进展停药,2例因不良反应停药,2例因疗效评价达到CR停药。不良反应方面,唯一1例IV级不良反应为IV度脂肪酶水平升高。此外,5例(11%)出现AST升高,4例(9%)出现ALT升高。而之前人们所担心的自身免疫性疾病及肝功能障碍并没有出现。近期疗效方面,CR2例(5%),PR6例(14%),SD20例(48%),PD14例(33%)。同时,研究结果还显示,在HBV感染组、HCV感染组和无病毒感染组,均有肿瘤缩小的患者。对于治疗有效额患者,其疗效是持久的。2名CR患者在用药3个月内即获得了CR,并持续缓解了18个月。所有PR、SD的病例中,均观察到这种持续性。该研究指出,用PD-1抗体Nivolumab治疗在HCC患者中产生持久的反应,这是免疫检查点抑制剂最独特和显著的特征。
⑵目前正在进行的II期临床研究结果
在上述研究的基础上,研究者将Nivolumab剂量确定为3mg/kg,同时将样本量扩大至214例,结果显示所有研究对象中,CR2例(1%),PR33例(15%),SD111例(52%),PD63例(29%)。9个月生存率达到了70%。副作用方面3-4级AST升高比率为4%,3-4级ALT升高比率为3%,对于病毒性肝炎患者,使用Nivolumab后并未出现严重肝功能障碍的患者。剂量增加队列(48例)的附加分析显示,分别有6%、8%的患者获得CR、PR;SD、PD者分别为50%和36%。亚组分析显示,肿瘤反应率(CR+PR)HCV感染组最高,达30%,其次为无病毒感染组(13%),HBV感染组仅为7%。
⑶目前开展的III期临床研究
目前开展的PD-1抗体治疗HCC的III期临床研究主要有两项,一项是直接比较Nivolumab与Sorafenib一线治疗进展期HCC的临床研究;另一项为Pembrolizumab与安慰剂比较二线治疗对Sorafenib无效的HCC研究,上述研究的结果尚未报道。此外,CTLA-4抑制剂治疗HCC的研究也在开展,但初步结果发现其副作用多于PD-1抗体。不仅如此,抗PD-1/PD-L1抗体与抗CTLA-4抗体联合治疗进展期HCC的I/II期研究也已展开,结果同样值得期待。
2、有关PD-1联合治疗的问题
PD-1抗体联合治疗是否有首选方案,尚无定论,目前国际上PD-1联合治疗肝癌的研究主要集中在以下几个方面:
⑴ PD-1抗体与CTLA-4抗体的联合
这种联合治疗的基本原理是:当肿瘤中不存在靶淋巴细胞(CD8 + T细胞)时,抑制PD-1和PD-L1途径不能刺激癌症免疫微环境。然而,同时使用抗CTLA-4抗体确保了对B7-CTLA-4途径的抑制,导致淋巴结中的CD8 + T细胞增殖及其向肿瘤组织的浸润,因此增强了抗肿瘤作用。此外,肿瘤微环境中的抗CTLA-4抗体可以抑制表达表面CTLA-4的Treg细胞的肿瘤抑制作用。
这种联合治疗方法目前正在开展I/II期临床试验,其中I期试验的数据已经公布, 40例患者的客观有效率为25%,20例未感染病毒患者的有效率为40%。II期实验数据将在18年4月公布。
⑵ PD-1抗体与局部治疗的联合
前期的临床探索发现,放射治疗和其他局部治疗(如经导管动脉化学栓塞<TACE>和射频消融<RFA>)可以通过诱导局部炎症和释放抗原来激活免疫系统并提高PD-1抗体的疗效。
研究表明,放疗、TACE和RFA通过释放肿瘤相关抗原并刺激细胞毒性T淋巴细胞迁移到小的肝内转移性结节来诱导肿瘤免疫原性。因此,抗PD-1抗体的随后施用可以控制这些小的肝内转移性结节。有一项研究就显示RFA显着增加了62%的患者中肿瘤抗原特异性T细胞的数量,证实了肿瘤相关抗原的释放。这项研究还显示,高水平肿瘤抗原特异性T细胞患者的无复发生存率显着高于低水平肿瘤抗原特异性T细胞患者。
⑶PD-1抗体与靶向药物的联合
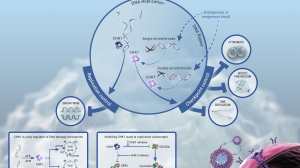
在肝脏微环境中,具有免疫抑制作用的细胞包括肝脏间质细胞中的枯否细胞,树突细胞,内皮细胞和肝星状细胞,以及免疫抑制细胞因子如白细胞介素(IL)-10和转化生长因子(TGF)-β以及PD-1 / PD-L1途径。 这种免疫抑制环境可能被分子靶向药物和免疫检查点抑制剂的组合所改变。以下是目前正在开展的靶向联合免疫治疗的临床试验:

目前,日本正在开展一项乐伐替尼联合K药的I期临床试验,具体实验设计如下:

在临床前的基础研究中,pembrolizumab和lenvatinib抑制肿瘤相关巨噬细胞和Treg诱导的癌症免疫抑制环境,降低TGF-β和IL-10的水平,PD-1的表达和Tim-3的抑制,从而触发由免疫刺激性细胞因子如IL-12介导的抗癌免疫性。这些基础研究可以为寻找适用于免疫检查点抑制剂的分子靶向药物提供参考依据。
3、有关肝癌靶向药物耐药的问题
以索拉非尼为例,目前认为,该药物产生耐药的机制主要有以下几点:
1、HCC的表皮生长因子受体的高表达。研究表明,EGFR高表达的肝癌细胞株,对索拉非尼的敏感性较差,低表达者敏感性强。而超过半数的HCC患者EGFR处于高表达状态,因此可引起索拉非尼的原发性耐药。
2、HCC 细胞 EGFR 下游信号通路的变化。目前研究认为与索拉非尼耐药相关的通路包括:Ras/Raf/MEK/ERK通路、PI3K/Akt通路和JAK/STAT通路,这三条通路均可以促进肿瘤细胞增殖、抑制凋亡。在通常情况下,Ras/Raf/MEK/ERK通路活性较强,而索拉非尼正是通过抑制这条通路上的相关靶点,阻碍信号传导,起到抑制肿瘤细胞增殖作用的。但是,在这条通路被抑制的情况下,肝癌细胞会“自我调节”式地加强另两条通路的信号传导,从而重新促进其自身的增殖能力。也就是说Ras /Raf /MEK/ERK 通路的活性下调及PI3K/Akt 和 JAK/STAT3 信号通路的异常激活,降低了HCC 对索拉菲尼的敏感性。
3、在索拉非尼的“刺激”下,肝癌细胞可以使一些平时低表达的蛋白表达数量增加(如沉默信息调节因子1< silent information regulator 1, SIRT1>),这类蛋白数量增加以后,可以对抗索拉非尼对肝癌细胞的抑制作用,促进细胞增殖,抑制细胞凋亡。
4、由于索拉非尼会使肝癌组织处于一种“乏氧”状态,而在“乏氧”状态下,肿瘤细胞与周围其他细胞的 “上皮-间充质转变”(EMT)会加强,从而增强了肿瘤的迁移性和侵袭性。
5、索拉非尼虽然可以抑制大部分的血管生成信号通路,但不是全部。肿瘤新生血管形成的 3 条主要信号通路为: VEGFR、PDGFR 和纤维母细胞生长因子( fibroblast growth factor,FGF) 酪氨酸激酶受体相关通路。HCC 对索拉非尼耐药有可能与 FGF 信号通路上调有关。
本文仅供医学药学专业人士阅读






.jpg-pd13)


-scaled-e1698827217272.jpg-pd13)












 X
X