EGFR在癌症发生与发展中起着重要作用,针对该突变,可采用分子靶向治疗。相关研究证实,采用EGFR-TKI治疗可显著提高患者的生活质量,延长生存期,为患者带来显着获益。然而,在长期的治疗过程中,耐药性是不可避免的,小细胞转化的发生是耐药性的重要机制之一。在此,我们报道一例肺腺癌EGFR-TKIs治疗后发生小细胞肺癌转化的病例【1】,并探讨其特点及相关机制。
案例展示
75岁男性,无吸烟史,因反复咳嗽咳痰1个月入院,胸部增强CT示左肺下叶支气管旁软组织肿块,考虑为是中央型肺癌。2020 年 7 月,肺活检病理显示左肺腺癌 (cT3N3M1 IVA)(图 1A)。由于 ECOG 体能状态 (ECOG PS) 2,他使用培美曲塞加贝伐珠单抗实现了 1 个周期的化疗,没有铂方案。两周后,活检组织的下一代序列 (NGS) 结果显示,患者携带EGFR L858 突变。通过吉非替尼的治疗,他获得了大约 8 个月的临床显着反应。
图1。
进展后,第二次NGS检测显示EGFR L858R T790M突变和PIK3CA E545K突变。然后给予奥西替尼。但仅2个月后出现腹痛,CEA(254.38 ng/mL)较前降低,神经特异性烯醇化酶(NSE)(27.32 ng/mL)较前升高,左肺病理支气管镜示小细胞神经内分泌癌(图1B), 2021年7月EGFR L858R突变,RICTOR拷贝数增加,PD-L1 < 1%。患者接受依托泊苷+奈他铂2周期化疗,部分缓解。CEA (209.57 ng/mL) 和 NSE (15.25 ng/mL) 均低于之前。然而,由于副作用,他拒绝继续化疗。然后患者接受埃克替尼和安罗替尼治疗。
5 个月后,疾病广泛进展,出现骨、肝和多发淋巴结转移。2022年1月20日全血NGS检测EGFR L858R和T790M突变,PIK3CA e545K突变,ERBB2拷贝数增加。CEA (1142.66 ng/mL) 比之前高 5 倍,NSE (32.59 ng/mL) 比之前高 1 倍。 根据基因检测结果,该患者接受了奥希替尼治疗。不幸的是,患者于服药第三天即2022年1月23日因严重感染和肝功能衰竭离世。
图 2。治疗过程中NSE和CEA水平的变化
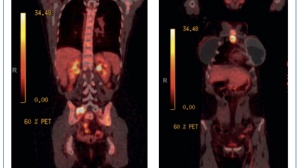
图 3。EGFR-TKI 治疗后肺腺癌向小细胞肺癌转化的病例报告。



案例讨论
使用第一代 EGFR-TKI 治疗的具有 EGFR 敏感突变的晚期非小细胞肺癌 (NSCLC) 患者的中位无进展生存期约为 10 至 12 个月。该患者在吉非替尼治疗后(8 个月)的无进展生存期比报告的数据短。
更令人惊讶的是,他是 T790M 突变阳性,但没有从第三代 EGFR-TKI 中获益。其原因可能是因为他有几个共突变基因,或者因为肿瘤的异质性,肿瘤组织之间产生不同的亚克隆,导致全血NGS检测的敏感性和特异性达不到100%,所以患者不能受益于第三代 EGFR-TKI。
Marcoux 等研究了 59 例 EGFR 突变的转化型小细胞肺癌(translational small cell lung cancer,SCLC)患者的组织基因分型,发现所有患者都保留了最初的 EGFR 突变,19 例 EGFR T790M 阳性患者中有 15 例在转化为 T790 野生型时突变为 T790 野生型SCLC 和其他突变包括 TP53、Rb1 和 PIK3CA,以及其他新突变的产生。此外,中枢神经系统转移通常发生在转化为小细胞肺癌之后。这与保留原有EGFR突变,T790变为野生型,转化后发生脑转移的病例一致。
目前有2种EGFR-TKIs耐药机制得到进一步研究。首先,EGFR-TKIs治疗过程中发生EGFR-T790M突变,导致EGFR-TKIs活性丧失,导致耐药。其次,MET 受体酪氨酸激酶的扩增导致 EGFR 非依赖性下游细胞内信号的激活,从而导致耐药性。此外,病理类型转换(NSCLC向SCLC)、KRAS、PIK3CA、TP53和Rb1突变等耐药机制尚不清楚。
对于转化型小细胞肺癌,目前尚无明确的标准治疗指南,在原发性小细胞肺癌治疗策略的基础上,仍采用以铂类为主的双药治疗。经复查,病灶较前小,患者对本次治疗敏感。但其与原发性SCLC具有相同的生物学特性,易复发,病情进展快,易发生中枢神经系统转移,患者转化为小细胞肺癌后表现出上述特征。
T-SCLC潜在治疗选择
一项回顾性小样本研究【2】首次报告了接受基于 PD-L1 的联合治疗 +/- 抗 VEGFR 的晚期EGFR突变 NSCLC 转化为 SCLC 的患者,评估了T -SCLC的基线特征和临床结果。
进行 SCLC 转化时,治疗选择很少;因此,需要评估进一步的治疗方法。接受 SCLC 转化的EGFR突变 NSCLC患者的免疫治疗反应存在争议。一项研究表明,PD-1/PD-L1 抑制剂在 17 例 SCLC 转化后的患者中没有显示出临床获益。同样,另一项回顾性研究表明,15 名患者接受 ICI 单药治疗或纳武单抗加易普利姆玛,mPFS 仅为 1.3 个月。 基于上述证据,PD-1/PD-L1 单一疗法对于组织学转化的患者可能不可行。然而,在 6 名接受化疗联合 PD-1/PD-L1 治疗转化的高级别神经内分泌肿瘤的患者中,3 名患者表现出临床反应,mPFS 为 5.6 个月。此外,一份病例报告使用免疫疗法加化学疗法对T -SCLC取得了相对持久的反应。验证对T的免疫联合治疗的反应-SCLC,分析了研究队列的临床疗效。两位资深肿瘤学家评估的mPFS为5.1个月,优于传统化疗的历史数据。与原发性SCLC一线ECT方案5.2个月的mPFS相比,联合免疫治疗T -SCLC的疗效值得肯定。然而,I/O 组的中位 OS 显着长于非 I/O 组,治疗后发生 SCLC 转化(20.2 m vs 7.9 m,HR = 0.30,95% CI:0.16 – 0.58,P< 0.01),比报告的 mpOS 数据长(mpOS:10.9 m,95% CI:8.0 m – 13.7 m)。
随后,进行了可能与预后相关的亚组分析,包括 PD-L1 表达和EGFR突变亚型。先前的研究表明,高 PD-L1 表达可积极预测 NSCLC 对免疫治疗的反应。在研究中,PD-L1 阳性患者的 mPFS 在数值上比 PD-L1 阴性患者更长(6.0 m 对 3.7 m,HR = 0.39,95% CI:0.10 – 1.46,P = 0.20)。此前,FLAURA 试验的亚组分析表明,EGFR 19del 对奥希替尼的反应时间优于 L858R。有趣的是,在我们的研究中,EGFR的 PFSL858R 亚组显示出比 19del 亚组更长的趋势,这与之前特瑞普利单抗联合化疗的亚组分析一致。同样,一项多中心回顾性研究显示,与EGFR野生型相比, EGFR 19del肺癌的生存结果更差类型(WT)。然而,与EGFR WT 肿瘤相比, EGFR L858R 患者的 OS 相似。这可能是潜在的证据,表明在肺癌中携带EGFR L858R 可以从基于免疫的治疗中获得更好的生存结果。
总之,PD-L1 抑制剂联合化疗±贝伐珠单抗可作为特定EGFR突变 NSCLC 向 SCLC 转化患者的治疗选择,这些患者的 mPFS 在数值上更长,并且显着改善了 pOS。SFTPA1 上调、EGFR L858R 突变或 PD-L1 高表达的T -SCLC可能受益于基于 PD-L1 抑制剂的联合治疗,这将有助于进一步做出更精确的临床决策。
参考文献: 【1】Chen X, Li D, Miao K, Shou T, Zhang W. Small cell lung cancer transformation after EGFR-TKIs treatment in lung adenocarcinoma: A case report and literatures review. Medicine (Baltimore). 2023 Jan 27;102(4):e32697. doi: 10.1097/MD.0000000000032697. PMID: 36705363; PMCID: PMC9875995. 【2】Zhang C Y, Sun H, Su J W, et al. A potential treatment option for transformed small-cell lung cancer on PD-L1 inhibitor-based combination therapy improved survival[J]. Lung Cancer, 2023, 175: 68-78.
本文仅供医学药学专业人士阅读



.jpg-pd13)


.jpg-pd13)

.jpg-pd13)
















 X
X