近日,Syndax和Nektar宣布了一项临床合作,评估Nektar NKTR-214和Syndax的entinostat联合使用,治疗曾接受过抗PD-1(程序性死亡受体-1)药物的转移性黑色素瘤患者的安全性与有效性。
总部位于美国马萨诸塞州的Syndax是一家生物医药公司,开发了一系列临床和临床前阶段的创新性癌症治疗药物。总部位于美国旧金山的Nektar Therapeutics生物医药公司在肿瘤学,免疫学和疼痛领域拥有强大的药物开发管道,以及一系列经批准的合作药物。

Entinostat是Syndax的口服小分子1类特异性HDAC抑制剂。在临床前试验中,entinostat和NKTR-214的组合显著抑制了肾和结肠癌模型中的肿瘤生长。该组合的抗肿瘤活性,随着肿瘤中CD8 + T细胞的激活和细胞毒性活性,以及肿瘤微环境中的免疫抑制细胞调节急剧增加。这项成果最近发表在了2018年美国癌症研究协会年会(American Association of Cancer Research Annual Meeting)上。此外,entinostat目前正在3期临床试验中与依西美坦(exemestane)联用,治疗激素受体阳性,人表皮生长因子受体2阴性的晚期乳腺癌,并被FDA授予突破性疗法认定。

▲Entinostat的作用机制(图片来源:Syndax官网)
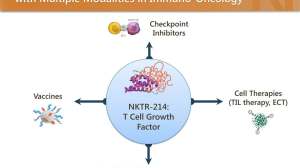
NKTR-214是一种在研的CD122偏好激动剂,旨在通过靶向CD8+效应T细胞和自然杀伤(Natural Killer)细胞的表面上的CD122特异性受体,来刺激体内抗癌的免疫细胞。在体内培养这些肿瘤浸润淋巴细胞(TILs)补充免疫系统对许多患者至关重要,尤其是对那些缺乏足够的TIL而不适用检查点抑制剂疗法的患者群体。在临床前研究中,NKTR-214导致这些细胞迅速扩张,并且动员到肿瘤微环境中。它具有与现有已批准的检查点抑制剂类似的类抗体给药方案。
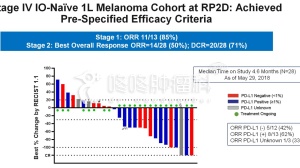
根据协议条款,Syndax和Nektar将合作进行一项研究评估这个组合。试验的1b期部分旨在确定组合给药方案的安全性和推荐剂量。2期临床部分旨在评估疗效,如客观缓解率和缓解持续时间,以及无进展生存期(PFS)和总生存期(OS)。患者的相关生物标志物将纳入分析,包括探索性分析经典外周血单个核细胞水平升高的潜力。Syndax将负责进行1b / 2期试验,协议中的一项规定包括双方可扩大合作范围,基于共同利益进行关键试验。
Syndax公司首席执行官Briggs W. Morrison博士说:“我们很高兴能与Nektar合作,建立临床合作战略,测试entinostat与前沿免疫疗法的新颖组合。在肾细胞癌中使用entinostat和高剂量IL-2治疗的2期临床数据以及我们使用NKTR-214的有前途的临床前数据,奠定了此次合作的科学和临床基础,与Nektar合作使我们能够对于PD-1难治性的转移性黑色素瘤患者进行有效治疗,也补充了我们在类似人群中,联合使用entinostat的Keytruda令人兴奋的数据。”

▲Jonathan Zalevsky博士(图片来源:Nektar)
Nektar高级副总裁兼首席科学官Jonathan Zalevsky博士说:“NKTR-214和entinostat的组合,证明了我们的临床前模型具有独特的协同作用,需要在临床上进一步研究。重要的是,我们观察到组合疗法治疗后,细胞因子阳性的肿瘤浸润性T细胞的水平升高,我们相信这一重要的临床前发现可以转化为对接受检查点抑制剂后,难以治愈的患者的缓解。我们期待与Syndax一起合作将这个组合推向临床。”
我们希望这项合作可以为我们带来新型抗癌组合疗法,为患有多种类型癌症的患者带来缓解。
参考资料:
[1] Syndax and Nektar Therapeutics Announce Immuno-Oncology Clinical Trial Collaboration
[2] Syndax官网
本文仅供医学药学专业人士阅读



















 X
X