截至目前,结直肠癌(CRC)已经成为发病率居于全球第三位,死亡率居于全球第二位的恶性肿瘤[1]。面对CRC居高不下的发病率与死亡率,我国也着力创建CRC的规范化诊疗与全程化管理模式,力求为CRC患者带来更长时间的生存获益。落实CRC的一线到后线的规范化、全程化治疗,也给一线临床医生带来了新的要求与挑战。
为此,中国临床肿瘤学会结直肠癌专委会与和黄医药携手举办2022年“优YOUNG好医声——晚期结直肠癌全程管理病例演讲”,邀请多位临床医生为我们分享临床一线经典诊疗案例,并邀请多位领域大咖参与点评,会议内容丰富详实。在8月6日的华北站中,来自首都医科大学附属北京潞河医院肿瘤中心程瑜蓉医生带来的“‘肠路漫漫’一例“直肠癌的病例思考”引发众多大咖点评肯定,在此我们共同回顾精彩。
-
现病史:2019年5月患者无明显诱因出现“便后鲜血”,为进一步求诊,入院治疗。
-
入院肠镜检查提示:至距肛门约12cm直肠可见一环全周生长菜花样肿物,表面凹凸不平,质脆,易出血,肠腔狭窄,镜身不易通过。完善病理检查提示:溃疡型中分化腺癌;
-
入院全腹CT提示:直肠近段局限肠壁增厚,局部肠腔变窄,肠壁异常强化及周围增大淋巴结, 考虑直肠癌淋巴结转移;
-
患者入院后完善术前相关检查,于2019年5月19日行“直肠癌根治术”;
-
术后病理提示:(直肠)溃疡型腺癌,中分化,部分为粘液腺癌(占比5%),肿瘤大小为5cm*4cm*7cm,癌组织局灶侵犯浆膜层,可见神经侵犯,未见明确脉管内癌栓。余肠粘膜见高级别管状腺瘤一枚。 远端、近端及环周切缘均未见癌。肠周淋巴结可见转移性癌(1/16),及癌结节一枚;
-
免疫组化:MLH1(++),MSH2(+++),MSH6(+++),PMS2(++) HER2(1+),Ki67(60%+);
-
基因检测:KRAS 2号外显子突变,NRAS/BRAF/PIK3CA未突变;
直肠(高位)中分化腺癌(pT3N1cM0,IIIB期),pMMR,HER-2(1+),KRAS 2号外显子突变;
术后辅助化疗:XELOX8周期,末次化疗时间为2019年11月20日,无进展生存时间(PFS)达15个月;
-
2020年7月,患者出现无明显诱因出现刺激性干咳,伴腹胀;
-
实验室检查:CA125:975.6 U/ml;CEA:34.95 ng/ml;CA199:112.08 ng/ml;
-
全腹CT:直肠癌吻合口旁异常强化结节,下腹部及盆腔囊实性肿块伴异常强化,腹膜及大网膜增厚,考虑转移,腹盆腔积液;
-
免疫组化:Calretinin(间皮细胞+),MC(少数间皮细胞+),D2-40(散在间皮细胞+), WT-1(间皮细胞+),TTF-1(-),CK7(间皮细胞++), NapsinA(-),CK5/6(间皮细胞+),CK20(散在+),Ki67(约3%+),CD68(组织细胞+),Vimentin(-), CDX-2(散在个别+),Villin(散在+),SATB2(-);
-
胸水细胞学:可见散在少量肿瘤细胞, 结合病史及免疫组化:肠道来源可能;
-
肠镜检查提示:距肛门10cm直肠粘膜充血、水肿;镜下诊断:直肠炎可能;病理提示粘膜慢性炎;
患者诊断为:直肠中分化腺癌(高位)术后IVB期,伴肺转移、胸膜转移、腹膜转移、卵巢转移,同时有癌性胸腔积液和中量腹盆腔积液。该患者目前年龄为41岁,ECOG 0分,器官功能好,无合并症,治疗态度积极。经多学科诊疗团队(MDT)讨论,给予患者胸腔灌注贝伐珠单抗以及4周期贝伐珠单抗+FOLFIRI一线治疗方案。
患者腹膜转移灶、胸腹腔积液达到部分缓解(PR),肺转移病灶疾病稳定(SD),卵巢转移病灶体积显著增大。
基于患者卵巢转移病灶明显增大,有肿瘤破裂风险,且卵巢转移灶对化疗不敏感。同时患者前期治疗耐受程度较好,治疗态度积极,经MDT讨论安排患者行:腹腔肿瘤减灭术(CRS+HIPEC),患者于2020年11月25日行双侧输卵管-卵巢肿瘤切除术+盆腔病损切除术+腹膜病损切除术+肠系膜病损切除术+阑尾切除术+腹腔粘连松解术+子宫肌瘤切除术;行腹腔热灌注治疗(DDP)1次,后继续全身治疗。
手术病理:卵巢肿物右、卵巢肿物左(送检肿物)为中分化腺癌,部分呈粘液腺癌,伴大片肿瘤性坏死,肿瘤大小26*21*4.5cm、11*8*4.5cm。结合免疫组化及病史考虑为直肠来源;(盆底腹膜)送检纤维脂肪结缔组织内可见少量中分化腺癌浸润,结合免疫组化结果及病史考虑为直肠来源;
基因检测:KRAS基因p.G12C突变,MSS,PD-L1(-);
围手术期2020年12月-2021年4月,患者行8个周期的贝伐珠单抗+FOLFIRI联合治疗,2021年4月-2021年7月再行贝伐珠单抗+卡培他滨治疗。
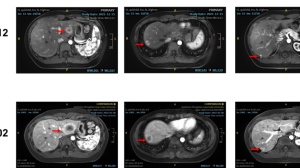
2021年8月30日影像学评估提示:患者肺部出现新发结节,且原先稳定结节出现增大,提示肺部出现疾病进展(PD),经MDT讨论,为患者更换呋喹替尼三线治疗方案。起始呋喹替尼剂量为5mg,期间患者出现少许蛋白尿及轻度高血压,后调整为4mg后耐受性较好;2022年4月行胸部CT后发现 右肺上叶空洞性病变伴邻近斑片影,余未见明显变化。
在2022年的3月——4月期间,患者出现肺部曲霉菌感染,予以伏立康唑抗真菌治疗后好转。至病例汇报截止时间,患者仍继续使用呋喹替尼进行治疗,总体情况SD,总生存期(OS)达39个月。
导师王莉教授表示针对上述晚期CRC伴全身多发转移患者的精彩案例,目前OS已超39个月实属不易。对于该例患者的治疗选择,始终是基于转移性结直肠癌(mCRC)全程管理的模式下进行,每一线的治疗在参照指南的基础上经MDT讨论进行决策,患者的长时间生存获益与此密不可分。贾漪涛教授也认为该典型病例诠释了患者每一线治疗的选择与决策都是为患者获取更长的PFS打下坚实的基础。在全身治疗肿瘤控制良好的基础上,大胆地积极给予患者局部治疗。当出现卵巢转移时二线治疗中为患者选择了CRS+HIPEC的局部治疗为患者带来了9个月的PFS。而当患者肺部原先结节增大且出现新发结节时,在三线治疗上选用了呋喹替尼这一抗血管生成的靶向药物,为患者带来11个月的PFS且目前持续获益。期待呋喹替尼后续能够为患者带来更长久、安全的生存获益。
KRAS突变,直肠(高位)中分化腺癌伴胸腹部多发转移患者(pT3N1cM0,IIIB期),经过MDT多次讨论,在全身治疗的基础上结合胸腔灌注贝伐珠单抗、CRS+HIPEC等局部治疗有效控制疾病进展,三线呋喹替尼治疗方案迄今为止PFS已近1年。该真实世界治疗患者总OS达到39个月,且血清肿瘤标记物稳定,提示呋喹替尼三线治疗患者耐受性良好,为多发转移晚期CRC患者后线带来显著生存获益。

[1].Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.




.jpg-pd13)


.jpg-pd13)
.jpg-pd13)
.jpg-pd13)
.png-pd13)












 X
X