
1. 膳食对机体慢性炎症的影响
机体的慢性低度炎症状态是诱发肿瘤的机制之一。Gaur P 等[5] 研究了炎症标志物与肺癌风险的关系,与健康对照者相比,肺癌患者血清中 C 反应蛋白(Creactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素 6( inter-leukin-6,IL-6)和 IL-8 水平明显升高,并指出这些生物标志物可能是肺癌诊断的有效工具。Frieden-reich CM 等[6]报道了一项病例对照研究,发现 CRP与子宫内膜癌风险之间存在关系,不同类型的子宫内膜癌患者的 CRP 水平都高于对照组。通过改变饮食模式来调节机体的炎症状态是行之有效的手段之一,膳食中的各种生物活性成分(包括能量与营养素)可影响人体内炎症反应过程。膳食模式与机体慢性炎症状态密切相关。大量研究表明,高比例的红肉、高脂食物与机体内促炎症因子 CRP、TNF-α 和 IL-6 有关[7]。地中海膳食模式可降低体内 TNF -α、IL – 6 及 CRP 等炎症因子水平[8]。因此,科学的评价膳食对机体的潜在炎症效应对肿瘤预防具有重要意义。
2. 膳食炎症指数概述
DII 是2009年由南卡罗来纳大学公共卫生研究人员开发[7],他们研究1950年至2007年发表的关于膳食成分与机体炎症因子相关的文献,开发了评估个体膳食炎症潜力的指标。2014 年,Shivappa N等[9]进行了更新。DII 包括 45 种膳食成分,每一种成分摄入量的增加或减少都会影响个体的 DII 评分。DII 的评分基于各项炎症标志物,确定炎症标志物的依据是从 1950 年至 2010 年的 1943 篇文献研究中得来,共有 6 种,即 CRP、IL – 6、TNF – α 、IL-1β、IL-10和IL-4。若一种食物能显著提高IL-1β、IL-6、TNF-α和CRP水平或降低IL-4和IL-10 水平,则赋予“ +1”评分,相反则赋予“ -1”评分。如果摄入的膳食成分没有使机体这 6 种炎症标志物发生变化,则认为该膳食成分没有炎性效应,赋予“0”评分。在实际应用中,通常需要获取个体整体饮食数据,最终评价饮食结构中DII,正值则代表膳食具有促炎倾向,负值代表膳食具有抗炎倾向,0则膳食不具有炎症效应[10]。
计算DII需要基于膳食成分摄入数据目,前已建立全球不同国家及地区人群的膳食成分摄入数据库,可获取每个食物成分含量的平均值和标准差。计算公式为:Z 评分= (该种膳食成分或营养素日摄入量-该种膳食成分或营养素全球人均日摄入量均数) / 该种膳食成分或营养素全球人均日摄入量标准差× 该种膳食成分或营养素炎症效应指数[11]。每一类食物经过计算可以得到DII评分。最后,将1d内所有食物的炎症效应评分相加,可以得到个体整体膳食DII评分。
3. 膳食炎症指数与肿瘤发病关系的证据
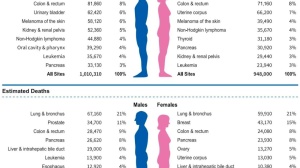
DII自提出以来就被广泛应用于膳食与各种肿瘤的关系研究当中其中,结肠癌、胃癌、食管癌、乳腺等与DII相关性的报道较多。表2展示了 DII 与肿瘤发病关系的流行病学证据,期望从膳食成分和炎症角度为肿瘤防治措施提供新思路。

4. 抗炎饮食肿瘤预防推荐意见
4.1 碳水化合物
推荐:全谷物碳水化合物具有抗炎效应并有利于维持稳定血糖水平。(推荐强度:强,证据分级:中级)
全谷物碳水化合物是抗炎饮食的重要成分,低加工碳水化合物中含有丰富的膳食纤维,膳食纤维的 DII 评分较低为-0. 663 / g[10]。全谷物碳水化合物可降低胰腺癌、乳腺癌、结直肠癌的发病风险[49],尤其是小麦麸皮及小麦的胚芽中富含膳食纤维及各种酚类植物化合物。研究显示,血糖生成指数较高的食物可以增加机体炎症水平[50],并与肿瘤发病率存在一定关系。Michaud DS 等[51] 研究表明,高血糖负荷的饮食可增加胰腺癌的发病风险,尤其在胰岛素抵抗的女性中相关性更明显。研究也证实,高糖饮食与结直肠癌[52]、胆管癌[53] 和肝癌[54]的发生呈正相关。精制淀粉的大量摄入会引起血糖和胰岛素水平大幅度波动,并可能升高机体内游离脂肪酸水平。而 Manije DM 等[55] 对 56 项研究进行 meta 分析,结果显示马铃薯或马铃薯制品摄入量与多个部位的肿瘤发生却无明显关系。
4.2 膳食脂肪酸
推荐:脂肪摄入量一般不超过总能量的30%,宜选择单不饱和脂肪酸和多不饱和脂肪酸,减少饱和脂肪酸和反式脂肪酸的摄入,有利于形成机体抗炎内环境。(推荐强度:强,证据分级:高级)
总脂肪的 DII 评分为 0. 298 / g[10],其中反式脂肪酸和饱和脂肪酸的 DII 评分较高,分别为 0. 429 / g和 0. 432 / g[10]。多不饱和脂肪酸的 DII 较低,其中ω- 3 多不饱和脂肪酸 ( polyunsaturated fatty acid,PUFAs)为-0. 436 / g。多项流行病学研究支持,降低ω-6 ∶ ω-3 PUFAs 的比例已被证明对人体健康有益,推荐膳食比例为(4~6) ∶ 1。平衡的 ω-6 ∶ ω-3PUFAs 的比例可降低机体炎症水平,降低肥胖和肿瘤的风险[56]。 研究显示,ω-3 PUFAs 能够抑制机体内炎症因子的合成,延缓胰腺癌患者恶液质的进展[57]。Colomer R 等[58] 研究表明,每天服用至少1. 5 g 的 ω-3 多不饱和脂肪酸补充剂与肿瘤患者体重、食欲、生活质量、治疗耐受性和生存率的改善,以及术后发病率的降低有关。Qiu W 等[59] 进行的 meta 分析发现摄入过多的饱和脂肪酸和反式脂肪酸使卵巢癌的发病风险升高。Zhao J 等[60] 对膳食脂肪酸与子宫内膜癌的关系进行 meta 分析,发现饱和脂肪酸可增加子宫内膜癌的患病风险,饱和脂肪酸的摄入量每增加 10 g / 1000 kcal,子宫内膜癌的患病风险就增加 17%。
4.3 蛋白质
推荐:蛋白质有轻微的促炎潜力,但由于肿瘤患者代谢紊乱,蛋白质消耗增加,建议肿瘤患者提高蛋 白 质 的 摄 入,推 荐 其 蛋 白 质 摄 入 量 为 1 ~1. 5 g / (kg·d)。如果合并肾功能损害,蛋白质的摄入量不应超过 1 g / ( kg·d)。(推荐强度:强,证据分级:高级)
蛋 白 质 有 轻 微 的 促 炎 潜 力, DII 评 分 为0. 021 / g[ 10]。肿瘤患者代谢紊乱,存在糖异生,并且自身营养也在恶性进行性消耗,故大部分的患者存在慢性的蛋白质-能量营养不良。建议肿瘤患者提高蛋白质的摄入量。蛋白质的最好来源为鱼、家禽、鸡蛋、瘦红肉、低脂乳制品、大豆食品、坚果等,尽量少食用加工肉类。多项 meta 分析研究显示,较高的鱼类摄入量与降低患肝癌、乳腺癌、胃癌的风险有关[61-65]。而家禽的摄入量与总体肿瘤的发病风险无关[64]。红肉和加工肉类的摄入量与肿瘤发病率呈正相关,Farvid MS 等[65] 进行 meta分析计算了红肉、加工肉的最高与最低消费类别的相对风险,结果显示红肉和加工肉类的总摄入量可使结直肠癌发病风险增加17%、肺癌增加20%、肾细胞癌增加19%。有动物实验证明羊肉可升高大鼠变应性接触性皮炎模型的炎症细胞计数和外周血 IL-35 和 TNF-α 水平,但在人群试验中未见羊肉与机体炎症水平和肿瘤发病情况的相关报道[66]。
4.4 蔬菜和水果
推荐:理想的抗炎饮食中蔬菜和水果应占总食物重量的 2 / 3。(推荐强度:强,证据分级:中级)
水果和蔬菜中含有丰富的维生素和矿物质,具有较好的抗炎活性。蔬菜水果中的 β-胡萝卜素,维生素 A、B6 、C、D、E,锌,镁的 DII 较低,尤其是 β-胡萝卜素为-0. 584 / μg[10]。Sears B[67] 指出抗炎饮食中应含有 2 / 3 的蔬菜和水果。meta 分析显示增加蔬菜水果的摄入可降低机体炎症标志物,对机体代谢产生积极影响[68]。Sakai M 等[69] 对有关水果和蔬菜消费以及食管癌风险的研究进行了系统回顾和 meta 分析,结果显示在亚洲地区,水果和蔬菜消费可能与较低的食管癌风险有关。
4.5 植物化合物
推荐: 部分植物化合物具有较大的抗炎潜力,在肿瘤防治中有积极效果,但其在肿瘤防治中剂量和疗程还有待进一步研究。(推荐强度:弱,证据分级:中级)
某些植物化合物具有较大的抗炎潜力,如黄酮、花青素、丁苯甲酸酯等多酚类植物化合物。其广泛存在于人们的日常饮食中,研究证明其可调节由肠道菌群介导的代谢并对炎性肠病具有保护作用[70]。大量的细胞培养试验和动物实验显示,黄酮醇、花青素等多酚类植物化合物具有抗炎、抗氧化、抗癌作用,并具有协同抗癌作用[71-72]。在肿瘤治疗中亦观察到了某些植物化合物的积极效果,但植物化合物的应用剂量与具体疗效有待进一步深入研究[73]。
4.6 酒精
推荐: 酒精虽具有抗炎潜力, 但在肿瘤防治中,应避免长期过量或大量饮酒,肿瘤患者应戒酒(推荐强度:强,证据分级:高级)。
酒精 DII 评分较低,为-0. 278 / g,具有一定的抗炎潜力[10]。酒精可导致多种肿瘤的发生,全球大约有 3. 6%的肿瘤与饮酒有关,尤其是男性。国际癌症研 究 机 构 ( International Agency for Research onCancer, IARC) 研究表明,2020 年新发肿瘤病例中有 741 300 例可能与饮酒有关,其中食管癌、肝癌和乳腺癌的病例最多[74]。值得注意的是,过量饮酒可导致能量摄入超标,从而增加肥胖相关肿瘤的发病率。此外,患者在放化疗过程中常伴有口干、口腔溃疡、胃肠道反应等症状,酒精刺激性强,故建议肿瘤患者应该戒酒。
4.7 茶
推荐:绿/ 红茶具有抗炎生物活性,可依据个人健康状况和习惯,适量饮用。(推荐强度:强,证据分级:中级)
绿/ 红茶具有抗炎潜力,其 DII 评分为-0. 536/ g[10]。Li Y 等[75]研究发现饮用绿茶对炎症相关细胞因子的多态性,尤其是 IL-10 具有潜在的影响。绿/ 红茶中可分离出没食子、儿茶酸、黄酮、多酚等成分,其对多种肿瘤有明确的预防效果[76-77]。茶多酚作为茶叶中的天然多酚植物化学物质,已被证明可有效预防结直肠癌,茶多酚能够阻断致癌物质亚硝酸胺在人体内的合成,同时还能抑制癌细胞的发展和突变[78]。虽然绿/ 红茶具有防治肿瘤作用,但要依据个人健康状况和习惯,饮用时注意适量。
4.8 烹饪方式
推荐:抗炎饮食的烹调方式应健康化,应以烩、炒、蒸、煮为主,少用煎、炸、烤等方式。(推荐强度:强,证据分级:高级)
油炸类食物中含有较多的反式脂肪酸。油炸的食物中反式脂肪酸含量增加。Guallar-Castillón P等[79]对 30 000 例中年人的横断面分析,研究了油炸对肥胖的影响,在大量摄入油炸食品的人群中观察到整体肥胖和中心性肥胖的增加。其他研究也表明,大量食用煎炸食品与心血管疾病、心力衰竭和糖尿病有关[80-82]。肉经高温烹调或煎炸可产生杂环胺和多环芳烃,并产生糖基化终产物,具有促炎性[83]。研究显示,红肉或肉类采用如油炸和烤的烹饪方式可增加结直肠癌的发病风险[84]。健康的烹饪方式,以蒸、煮、烩、炒为主,少用煎、炸、烤等方式。
结语
抗炎饮食模式是基于分子生物学的新突破,其借助 DII 评估饮食抗炎性潜力。多项研究也证实,DII 与肿瘤发病相关。本共识采用循证医学方法总结了促炎性饮食与各类肿瘤的发病关系,并提出肿瘤防治的抗炎性膳食模式。肿瘤高危人群采用此类膳食模式,可减小发生长期负面代谢后果的可能性。提倡科学健康的饮食行为,鼓励居民调整膳食结构,增加抗炎膳食的摄入,为肿瘤患者营养治疗提供新策略。
本文来源:石汉平医生
本文由医世象 佐罗整编,转载请联系授权。
引用本文:中国抗癌协会肿瘤营养专业委员会,中国营养学会社区营养与健康管理分会,中国营养学会临床营养分会.抗炎饮食预防肿瘤的专家共识[J].肿瘤代谢与营养电子杂志,2023,10(1):57-63.
本文仅供医学药学专业人士阅读



.jpg-pd13)



















 X
X