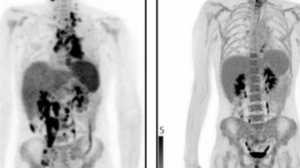
2021年,此时12岁的英国女孩Alyssa被诊断出患有急性T淋巴细胞性白血病,在接受了化疗和骨髓移植后不幸复发。
2022年5月,在伦敦大学学院和大奥蒙德街儿童医院(GOSH)的“bench-to-bedside”的合作中,13岁的Alyssa成为了第一位接受碱基编辑的CAR-T细胞疗法的临床试验的患者。28天后,Alyssa病情缓解并接受第二次骨髓移植以恢复她的免疫系统,如今,已经接受治疗6个月的Alyssa没有再检测到癌症,目前Alyssa继续在GOSH进行骨髓移植后的随访。
据悉,Alyssa的治疗中使用碱基编辑的CAR-T细胞由伦敦大学学院 Waseem Qasim 教授领导的团队制备,他表示,这是迄今为止最复杂的细胞工程疗法,为其他新疗法铺平了道路,也将为患病儿童创造更好的未来。

Waseem Qasim
碱基编辑技术是由刘如谦团队于2016年开发并逐步扩展、完善的一种新兴基因编辑技术,碱基编辑能够在特定点以高精度和高效率对单个碱基对进行编辑,且不依赖DNA双链断裂(DSB),因此被认为相比于CRISPR-Cas9具有更高的安全性。
碱基可以说是生命的一种语言。人类的基因都是由4种碱基组成——胞嘧啶(C)、鸟嘌呤(G)、腺嘌呤(A)、胸腺嘧啶(T),如字母表中的字母能够拼出带有意义的单词一样,我们DNA中的数十亿个碱基构成了人类身体的“说明书”。
碱基编辑这种方法可以让科学家们聚焦在遗传密码非常精准的位置,然后改变一个碱基的分子结构,将其转换成另一个碱基,并改变遗传指令。

在对Alyssa的治疗中,研究者使用碱基编辑技术来设计和改造来自捐赠者的健康T细胞,使其能够追踪并杀死体内的癌变T细胞。
使用碱基编辑技术进行基因敲除的原理是,通过修改单个碱基,将基因中的特定密码子改为终止密码子,从而导致该基因终止表达,实现基因敲除的目的。
该研究选择了CD7作为治疗靶点,CD7在绝大多数T-ALL细胞(95%)中高表达,然而,健康T细胞同样也表达CD7,这就会导致CAR-T细胞在杀伤T-ALL的同时,也会自相残杀。
来自捐赠者的T细胞用于治疗时,面临着几大难题,要避免患者的排异反应,防止移植物抗宿主病(GvHD),还要防止改造后的T细胞的自相残杀。
研究团队对捐赠者的T细胞进行了4步基因改造:
1. 使用碱基编辑敲除T细胞上的T细胞受体,这样一来,这些T细胞就成为一种“通用型”细胞,可以储存起来供不同患者使用;
2. 使用碱基编辑敲除T细胞上的CD7,防止CAR-T细胞的自相残杀;
3. 使用碱基编辑敲除T细胞上的CD52,这使得治疗过程中使用的其他药物不会杀伤CAR-T细胞;
4. 向上述经过三重碱基编辑的T细胞上加CAR,即添加CD7受体,从而使得CAR-T细胞能够特异性识别患者体内的表达CD7的癌变T细胞。
经过这些基因工程改造的CD7-CAR-T细胞,能够识别患者体内的癌变T细胞(高表达CD7),并进一步清除这些癌变T细胞。


急性淋巴细胞白血病(ALL)
急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)是急性白血病的一种类型,是儿童最常见的恶性肿瘤。主要起源于B系或T系淋巴祖细胞,白血病细胞在骨髓内异常增生和聚集并抑制正常造血,导致贫血、血小板减少和中性粒细胞减少;白血病细胞也可侵犯髓外组织,如脑膜、性腺、胸腺、肝、脾,或淋巴结、骨组织等,引起相应病变。其中,急性T淋巴细胞性白血病(T-ALL)占病例的10-15%,T-ALL是由于未成熟T细胞在骨髓和(或)淋巴组织中恶性增殖而导致的一种血液系统恶性肿瘤。
急性淋巴细胞白血病(ALL)的临床表现
1. 一般情况:起病大多较急,少数缓慢。早期症状有:面色苍白、精神不振、乏力、食欲低下,鼻衄或齿龈出血等;少数患儿以发热和类似风湿热的骨关节痛为首发症状,少数晚期患者可呈现恶液质状况。
2. 出血:以皮肤和黏膜出血多见,表现为紫癜、瘀斑、鼻衄、齿龈出血,消化道出血和血尿。偶有颅内出血,为引起死亡的重要原因之一。
3. 贫血:出现较早,并随病情发展而加重,表现为苍白、虚弱无力、活动后气促、嗜睡等,查体时发现面色、甲床、眼睑结膜不同程度的苍白。
4. 发热:约50~60%的患者首发症状为发热,热型不定。发热主要原因是白血病本身所致,这种发热用抗生素治疗无效,在诱导治疗72小时内缓解;其次是感染所致。
5. 感染:起病时常伴有感染,最常见的感染有呼吸道感染如扁桃体炎、气管炎和肺炎;消化道感染如胃肠炎;少数患儿发病时即有较严重的感染如脓毒血症。几乎任何病原体都可成为感染源,如真菌(念珠菌、曲霉菌、卡氏肺囊虫等)、病毒(单纯疱疹病毒、水痘病毒、巨细胞病毒等)都可导致感染。白血病患儿易于合并感染,与其免疫功能低下、白细胞数量减少及其功能异常,尤其中性粒细胞的数值减低密切相关。
本文仅供医学药学专业人士阅读







-1.png-pd13)










 X
X