今日,FDA宣布批准Poteligeo(mogamulizumab-kpkc)上市,治疗已经接受过至少一次全身性疗法的复发或难治性蕈样真菌病(mycosis fugoides, MF)或塞扎里综合症(Sezary syndrome, SS)成年患者。这是FDA第一次批准针对SS的药物,它同时为MF患者提供了更多治疗选择。

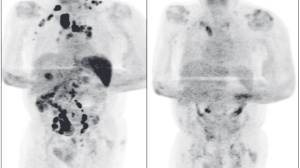
非霍奇金淋巴瘤是由于淋巴细胞癌变导致的癌症。MF和SS是癌变淋巴细胞影响皮肤的非霍奇金淋巴瘤类型。MF占所有皮肤淋巴瘤的50-70%,它能够导致瘙痒的红疹和皮肤伤口,并且可以扩散到身体其它部位。SS是影响血液和淋巴结的一种罕见皮肤淋巴瘤。
Mogamulizumab是Kyowa Hakko Kirin公司研发的人源化CC趋化因子受体4(CC chemikon receptor 4, CCR4)单克隆抗体。CCR4是在包括皮肤T细胞淋巴瘤在内的某些血癌白细胞上表达的蛋白。该公司独创的POTELLIGENT技术降低了这一抗体的糖链结构中的岩藻糖(fucose)成份,从而增强了由抗体媒介的细胞毒性。FDA已经授予它突破性疗法认定和优先审评资格。

这项批准是基于名为MAVORIC的开放标签,多中心,随机临床3期试验的结果。在这项临床3期试验中,总计372名MF和SS患者接受了mogamulizumab或伏立诺他(vorinostat)的治疗。伏立诺他是现有的治疗复发或难治性皮肤T细胞淋巴瘤的化学疗法。
试验结果表明,接受mogamulizumab治疗的患者的无进展生存期(PFS)显著长于接受伏立诺他治疗的患者。Mogamulizumab组的平均PFS为7.6个月,而伏立诺他组的平均PFS为3.1个月(p<0.001)。Mogamulizumab和伏立诺他的总缓解率分别为28%和5%(p<0.001)。
“MF和SS是罕见且难于治疗的非霍奇金淋巴瘤,这一批准满足了这些患者的未竟医疗需求,”FDA肿瘤学卓越中心主任Richard Pazdur博士说:“对于这类能够给患者带来显著疗效的靶向疗法,我们将继续致力于加速它们的开发和审评。”
“MF和SS是可能导致毁容和令人衰弱的疾病。MAVORIC临床试验结果表明mogamulizumab与伏立诺他相比,能够在复发或难治性MF和SS患者中延长PFS,” Kyowa Kirin Pharmaceutical Development总裁Jeffrey S. Humphrey博士说:“我们期待MAVORIC试验主要结果的发布和与医疗和学术界的科学交流。”
参考资料:
[1] FDA approves treatment for two rare types of non-Hodgkin lymphoma. Retrieved August 8, 2018, from https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm616176.htm
[2] Kyowa Kirin Announces FDA Approval of Poteligeo® (mogamulizumab-kpkc) for the Treatment of Mycosis Fungoides and Sézary Syndrome. Retrieved August 8, 2018, from https://www.prnewswire.com/news-releases/kyowa-kirin-announces-fda-approval-of-poteligeo-mogamulizumab-kpkc-for-the-treatment-of-mycosis-fungoides-and-sezary-syndrome-300694118.html
[3] Kyowa Kirin, Retrieved August 8, 2018, from http://www.kyowa-kirin.com/index.html
本文仅供医学药学专业人士阅读






.jpg-pd13)

-scaled.jpg-pd13)













 X
X