AKT信号通路异常激活,是肺癌、乳腺癌、食管癌、膀胱癌等诸多实体瘤中常见的致癌原因。
一直以来,国内外制药企业都在研发靶向AKT突变的靶向药,然而进展缓慢。
在此之前,最接近成功的靶向药之一是阿斯利康公司研发的AZD5363,该药物用于治疗AKT1突变的实体瘤具有一定的疗效。
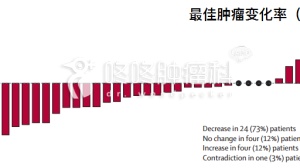
○ 52名AKT1基因E17K点突变的患者接受治疗后,4名激素受体阳性的乳腺癌、2名子宫内膜癌,1名宫颈癌、1名三阴性乳腺癌、1名非小细胞肺癌患者客观有效,疗效已经得到了确定;
○ 2名激素受体阳性的乳腺癌、1名三阴性乳腺癌、1名肛管腺癌的患者有效,疗效有待独立第三方评估后确认;
○ 一名携带AKT1基因Q79K的卵巢癌患者疾病稳定已超过14个月。
此后,AZD5363单药或者联合其他药物,在乳腺癌、前列腺癌、妇科肿瘤中进行了较多的探索。
2017年底,一项入组10名晚期去势抵抗的前列腺癌患者的I期临床试验,采用的治疗方案是AZD5363联合多西他赛化疗+泼尼松处理。
结果提示7名患者均出现肿瘤标志物PSA大幅下降。不过该方案的不良反应也不小,皮疹、腹泻以及高血糖较为突出。
同年年底,另外一项入组了24名AKT1突变的晚期激素受体阳性、对常规内分泌治疗无效的乳腺癌患者的I期临床试验公布了数据,患者接受的是AZD5363联合氟维司群治疗(入组前患者已经对氟维司群单药治疗无效,1/3左右的患者甚至对最新的CDK4/6抑制剂靶向治疗也已经耐药)。
治疗后,临床获益率是42%。治疗的副作用主要是腹泻、恶心、呕吐以及食欲下降,3-4级严重不良反应的主要是皮疹、高血糖以及背痛。
上述研究均为I期临床试验,不管是跨癌肿还是限定在特定癌种的。
第一项是在激素受体阳性的晚期乳腺癌患者中,当这部分患者接受普通的内分泌治疗失败后,一组接受氟维司群治疗,一组接受氟维司群联合AZD5363治疗。一共入组了140名患者,两组分别有71人和69人。
结果显示:AZD5363的加入,明显延长了无疾病进展生存时间,从4.8个月延长到了10.3个月,翻了一倍多。中位总生存时间也有延长的趋势,从20.0个月延长到了26.0个月。
在另一项名为“BEECH”的晚期乳腺癌的II期临床试验中,探索将AZD5363加到紫杉醇化疗中,结果显示相比于紫杉醇化疗,AZD5363的加入并没有增加疗效。
AZD5363联合内分泌治疗用于晚期激素受体阳性的乳腺癌患者,似乎颇有前景。此外,用于AKT1点突变的患者,也有进一步研究的价值。
不过,毕竟AZD5363尚未上市,而AKT1点突变的患者其实数量并不少,针对这些病人,有没有现成的已经上市的药物可以尝试一下呢?
这是一项基于美国癌症研究协会大数据库的汇总分析。研究者一共找到了153例AKT1基因E17K点突变的晚期乳腺癌患者和302例配对好的AKT1基因无突变的晚期乳腺癌病友。
经过其他干扰因素校正后,AKT1基因突变并不影响靶向药CDK4/6抑制剂的疗效,也不影响患者的总生存期。
同时该研究团队发现:针对AKT1基因突变,已经上市的依维莫司等mTOR抑制剂具有良好的疗效——接受依维莫司治疗的患者,AKT1突变的患者管用的平均时间为7.8个月,而无AKT1突变的患者管用的时间仅为4.5个月,有统计学差异。
综上所述,针对AKT1突变的病友,如果有机会参加AZD5363这个新药的临床试验,是可以考虑的;如果没有机会参与临床试验,在其他治疗均失败的情况下,或许也可以考虑试一试依维莫司。
[1]. ProCAID: a phase I clinical trial to combine theAKT inhibitor AZD5363 with docetaxel and prednisolone chemotherapy formetastatic castration resistant prostate cancer.Investigational New Drugs volume 35,pages599–607(2017)
[2]. Abstract P5-21-32: AZD5363 in combination withfulvestrant in AKT1-mutant ER-positive metastatic breast cancer. DOI:10.1158/1538-7445.SABCS17-P5-21-32
[3]. Capivasertib (AZD5363) plus fulvestrant versus placeboplus fulvestrant after relapse or progression on an aromatase inhibitor inmetastatic ER-positive breast cancer (FAKTION): A randomized, double-blind,placebo-controlled, phase II trial.DOI: 10.1200/JCO.2019.37.15_suppl.1005
[4]. BEECH: a dose-finding run-in followed by arandomised phase II study assessing the efficacy of AKT inhibitor capivasertib(AZD5363) combined with paclitaxel in patients with estrogen receptor-positiveadvanced or metastatic breast cancer, and in a PIK3CA mutant sub-population. https://doi.org/10.1093/annonc/mdz086
[5]. Characteristics and outcome of AKT1 E17K-mutantbreast cancer defined through AACR
Project GENIE, a clinicogenomic registry.DOI:10.1158/2159-8290.CD-19-1209










-1.jpg-pd13)
-1-scaled.jpg-pd13)
.jpg-pd13)













 X
X