靶向MET信号通路的抑制剂研发起得很早,进入临床的候选也很多。最初辉瑞的Crizotinib本是设计用来靶向MET的,早在10几年前就已经开始了临床研究,中间转道开发成了ALK抑制剂并于2011 年获得FDA批准。现在ALK的抑制剂1代加2代已经获批了4个,3代辉瑞的lorlatinib都NDA开始申请上市了,而iMET的第一个还没有着落。靶向MET到底还有没有戏,靠不靠谱?
最近两个好消息让我相信iMET的春天也许近了。
首先是2018年3月28日,德国默克的MET小分子抑制剂Tepotinib因出色的早期临床数据获得FDA快速通道审批资格。而两个月后,2018年5月29日,辉瑞的Crizotinib获得FDA突破疗法认证(breakthrough designation),用于MET exon14 突变的非小细胞肺癌患者,有助于加速其临床开发。这是超过几打MET 抑制剂的第一次获得突破疗法认证,看起来好像不一样了。
iMET的峰回路转到底怎么回事?我们这里简单小结,浅析一下METi的最新进展。
MET信号通路简介
MET原癌基因编码的蛋白激酶属于酪氨酸受体激酶,在胚胎期和成人期均有表达。MET的配体是肝细胞生长因子(HGF),主要由间质细胞分泌。HGF和MET的结合能够促进细胞的增殖、迁移、分化和生长等。
Simplified schema of the MET signalling pathway

与肿瘤发生密切相关的HGF/MET信号通路的异常变异主要包括以下几种机制:
基因扩增:最早报道的MET基因扩增主要发生在胃癌。而胃癌的细胞株也是最为常用的MET依赖的体外肿瘤细胞研究模型。最初的定义MET/CEP7>2即为过量表达,如HER2在乳腺癌的过量表达即是这个标准,但现在看来对MET来说,这个标准太低了。可能要提高到至少MET/CEP7>5,甚至>10,才是主要驱动致癌变异。使用MET/CEP7>5的标准,肝癌中MET基因过量表达的比例可能也比较高,可达5-10%。
激活点突变:激活突变在肾细胞癌中较为常见,包括近膜区域(Juxtamembrane)的MET Tyr1003 突变,激酶区域的突变等。占肾癌10-15%的乳头状肾细胞癌中MET突变比例最高。
基因融合:MET融合突变最早报道于1991年,为TPR-MET突变。虽然属于可靶向的驱动突变,但突变频率非常低。最近在初级胶质瘤(15%; n = 40)和小儿胶质母细胞瘤(10%; n = 53)中发现较高比例的PTPRZ1–MET融合突变。在乳头状肾细胞癌中,发现大约有1%的MET融合突变。
HGF的过量分泌:经常在各种肿瘤中检测到较高比例,但多数情况下可能不是驱动致癌因素。
Exon 14 skipping突变:主要发生在MET氨基酸963-1009之间的缺失突变。这个是MET研发的game-changer,下面重点介绍。
MET structural alterations and oncogene addiction
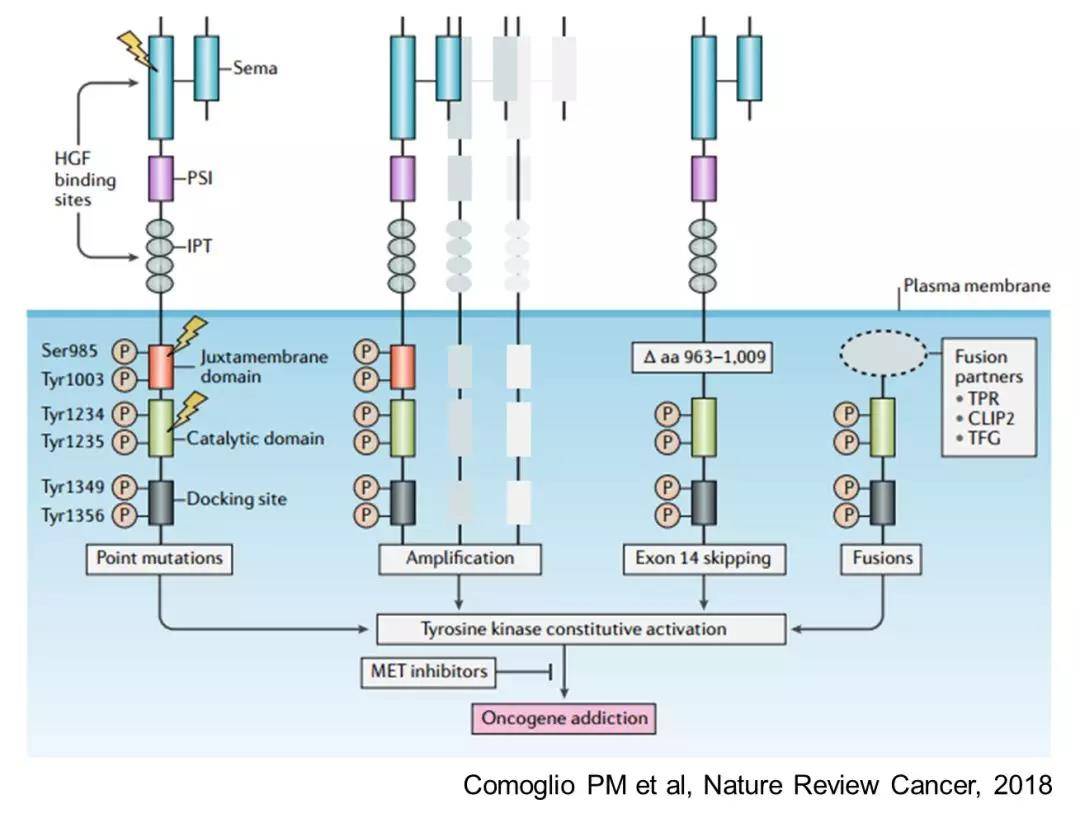
Exon14突变
如图示,exon14 区域突变最早报道于1994年,后来发现这个位置skipping突变可以引起近膜区域的Y1003磷酸化丢失,而Y1003磷酸化是MET蛋白泛素化降解所必须的。于是Exon14 突变则造成MET蛋白降解障碍,导致MET过度积累,活性异常增高,在多数情况下变成了驱动致癌因素。
2005年首次在非小细胞肺癌中发现exon14 突变。但直到2014年《自然》杂志报道的TCGA数据显示,非小细胞肺癌中有高达4.3%的exon14 突变以后,MET靶点才重新引起了人们的关注。在这之前则是无数次的iMET临床实验不利,或失败。
所以说,并不是exon14 突变本身多么的可靶向,而是量变引起了质变。主要发生在非小细胞肺癌的3-4%的这个驱动致癌突变因素使得临床开发变得可行。本来,MET融合突变应该是一个更靠谱的靶点,但由于没有富集的肿瘤突变类型和足够高的发病率,实际上开发起来困难重重。
Timeline of the emergence of the MET exon 14 skippingalterations in NSCLC

靶向MET的大、小分子抑制剂
理论上,靶向MET可以选择大分子抗体抑制MET本身,抑或MET的配体HGF。多个制药公司都有自己的大分子抗体药物,然而在临床开发过程中却发现,MET大分子抑制剂是个陷阱。各种尝试迄今都以失败告终。即使是在MET表达较高的人群中,也不容易看到获益。如图示。
MET抗体类抑制剂看不到疗效的原因迄今也不甚明了,一说是由于靶向MET或HGF的抗体不能有效抑制MET的激酶活性,而强大的反馈调控却引起了MET或HGF的进一步过量表达。
最新的HGF/MET抗体研究已经转战抗体加小分子ADC,用来增加活性,效果有待观察,本人对其前景不是非常看好。
HGF or MET targeting antibodies in clinical trials (all failed)

希望还在于MET的小分子激酶抑制剂。
MET小分子抑制剂可以分成三类:
一类Ia, Ib。小分子骨架均为U型。Ia的代表为crizotinib,其相对活性比ALK高2-5倍。Ib以capmatinib为代表,由于能够锚定MET较为独特铰链区域,Ib对MET选择性特别好,超过一打MET小分子抑制剂属于这一类。
II类以cabozantinib为代表,属于多靶点的TKI。其VEGFR活性远高于MET活性,靶向一线MET驱动致癌突变较为勉强。
III类是靶向活性形式的MET激酶,只有默克的MK2461。但由于细胞活性不够高,临床中疗效不明显,已经停止了临床开发。
Small molecule MET inhibitors

如前面提到,针对非小细胞肺癌exon14 突变是METi的最新热点。至少4-5个MET TKI 在积极进行临床开发,包括Crizotinib,Capmatinib,Tepotinib,Savolitinib等主要属于Ia,Ib类型的MET小分子抑制剂。根据最近揭露的数据,进展最快的当属前面提到的获得快速通道,及突破疗法的Tepotinib和Crizotinib。
最新公布的临床数据显示(截至2016年底), crizotinib在NSCLC 14号外显子突变的人群上,在28个患者中,有11个应答,应答率39%,中位应答持续时间达到9.1个月。由于crizotinib早于2011 即获FDA批准用于ALK融合突变阳性,2015年获批于ROS1融合突变阳性的非小细胞肺癌,其毒理,药理相对清楚,预计crizotinib将会是首个获批的MET 靶向药物。可能跟ROS1+类似,只要50-100个患者的数据就可以获得FDA批准。
最新在ASCO上Tepotinib公布的数据也非常积极。并且其临床设计也非常前卫。在组织检测的同时,设立了一组液体活检临床实验臂。在组织检测组,26个患者有11个应答,ORR为42.3%。液体活检组,16个患者中,9个应答,ORR 达到56.3%。组织检测与液体活检均为阳性的患者比例为77%,在这28名患者中, 12名应答,应答率为42.9%。根据以前Guardian报道的数据,在晚期肺癌患者中,经常有高达接近一半的患者没有合适的组织样品。有效的液体活检能够给这些患者一个应用靶向疗法的机会。为Tepotinib的液体活检临床实验设计点赞。
另外一个临床实验较为积极地是和记黄埔与阿斯利康合作开发的Savolitinib,在乳头状肾细胞癌及EGFR+的非小细胞肺癌中与EGFR TKI合用,均有积极数据,前景值得期待。
Tyrosine kinase inhibitors targeting MET exon 14 alterations and others Best Overall Response in clinic


MET抑制剂的耐药机制
因不同类别的MET TKI 而异,Ia,Ib,如crizotinib,capmatinib 等的耐药突变主要发生在激活环区域(activating loop),如D1228N, Y1230C 等,其突变可以被II类的MET TKI 如cabozantinib 及III类MK2461 克服。II类cabozantinib等的主要耐药突变与I类U型的骨架又不同,主要为 F1200突变【2017, AACR,#4100】。不同分子骨架的MET小分子大多能够克服相互之间的由激酶区域突变引起耐药机制,从而为良性循环用药提供了多种选择。
MET另外一种主要的耐药机制来自自分泌(autocrine),旁分泌(paracrine),即由于肿瘤自身不断分泌MET受体的激活配体HGF,提高了肿瘤的抗药性。或者通过反馈激活EGFR,FGFR,VEGFR等其它的信号通路达到耐药的目的。旁路耐药可能是MET TKI 临床应答期相对较短的主要原因之一。这就需要对不同的耐药机制进行具体个性化分析,从而选择合适的组合疗法来克服其相应耐药机制。
小结
在靶向MET的药物开发过程中,我们不缺优质的MET小分子抑制剂候选,难点在于有效,可靠的生物标记物的选择,即可靶向患者人群地选择。非小细胞肺癌中MET基因拷贝数量的增加一直以来被认为是一个有效靶点,约占2-3%,但临床开发进展非常缓慢。直到exon14 突变的出现,才重新吸引了大家对MET抑制剂开发的关注。最近METi在这部分患者中的积极应答使人相信,MET TKI也许出头之日不远了。
MET的突变人群与EGFR,ALK, ROS1等不同。MET+的患者年龄更大,肿瘤突变负荷接近均值,也许与免疫疗法合用有一定的增敏效果。
除了作为原发驱动致癌因素出现,MET过量激活也经常出现在其它靶向疗法的耐药机制中,如EGFR的旁路耐药机制,以及PARP 的耐药机制等。期待METi早日获批,造福患者。
参考文献
MET: a promising anticancer therapeutictarget. Peters S, Adjei AA. Nat Rev ClinOncol. 2012 May 8;9(6):314-26. doi: 10.1038/nrclinonc.2012.71. Review.
Comprehensive molecular profiling of lungadenocarcinoma. Cancer Genome Atlas Research Network. Nature. 2014 Jul31;511(7511):543-50. doi: 10.1038/nature13385.
The race to target MET exon 14 skippingalterations in non-small cell lung cancer: The Why, the How, the Who, theUnknown, and the Inevitable. Reungwetwattana T, Liang Y, Zhu V, Ou SI. Lung Cancer. 2017 Jan;103:27-37. doi: 10.1016/j.lungcan.2016.11.011.
Targeting MET in Lung Cancer: WillExpectations Finally Be MET? Drilon A, Cappuzzo F, Ou SI, Camidge DR. J ThoracOncol. 2017 Jan;12(1):15-26. doi: 10.1016/j.jtho.2016.10.014. Review.
Known and novel roles of the MET oncogenein cancer: a coherent approach to targeted therapy. Comoglio PM, Trusolino L,Boccaccio C. Nat Rev Cancer. 2018 Jun;18(6):341-358. doi:10.1038/s41568-018-0002-y. Review
Response to MET inhibitors in patients withstage IV lung adenocarcinomas harboring MET mutations causing exon 14 skipping.Paik PK, Drilon A, et al. Cancer Discov. 2015 Aug;5(8):842-9. doi:10.1158/2159-8290.
本文来源:药时代
本文仅供医学药学专业人士阅读






.jpg-pd13)


-1.jpg-pd13)
-1-scaled.jpg-pd13)
.jpg-pd13)













 X
X