去年7月,有文章曾介绍过美国波士顿达纳-法伯癌症研究所和德国缅因兹大学的科学家,使用个性化疫苗,在黑色素瘤的治疗中大获成功。时隔一年半,癌症疫苗又取得了重大进展,在缺少免疫细胞浸润的“冷肿瘤”中再下一城。
德国海德堡大学医院的科学家,使用预制的抗原文库中提取的疫苗,以及根据患者肿瘤中突变定制的个性化疫苗,治疗新诊断的胶质母细胞瘤患者,15名患者的中位总生存期为29.0个月,PFS时间达到14.2个月,患者最长生存期超过38.9个月[1]。
而美国波士顿达纳-法伯癌症研究所的科学家,也使用个性化的新抗原靶向疫苗治疗RTOG RPA分级III到V级的胶质母细胞瘤患者,激活了循环中的T细胞,并让其进入大脑,消灭胶质瘤,中位生存期也达到了16.8个月[2]。
作为对比,2000到2015年间,美国胶质母细胞了患者的1年生存率大约为40.2%,2年生存率为17.4%[3]。
这是癌症疫苗首次在缺少免疫细胞的“冷肿瘤”中取得成功!两个研究团队的成果在12月19日同时发表在Nature上。

肿瘤要想长起来,自然要逃避免疫系统的监视。比如一些肿瘤中,有大量的免疫细胞浸润,但这些免疫细胞却被肿瘤细胞招安了,不去攻击肿瘤细胞。
肿瘤细胞招安免疫细胞的方法有很多,最著名的就是PD-1/PD-L1等免疫检查点了,肿瘤细胞通过这些信号通路抑制了T细胞、NK细胞的功能。而针对PD-1/PD-L1的治疗方法,在多种癌症中都取得了很好的效果,并在今年获得了诺贝尔生理学或医学奖。
不过对于一些患者,免疫检查点抑制剂的疗效却不理想。
2014年,Alexandra Snyder通过分析接受过CTLA-4抗体治疗癌症患者的全外显子(WES)测序数据,发现肿瘤突变负荷(TMB)和治疗效果正相关,首次把TMB和免疫治疗联系起来[4]。随后,Timothy Chan在接受PD-1抗体治疗的非小细胞肺癌患者中,再次证实了肿瘤中较高的非同义突变负担与客观反应提升,持久的临床益处和无进展存活相关[5]。

肿瘤细胞的新抗原通常是基因突变产生的[6]。而那些携带突变少的肿瘤,表面能让免疫细胞识别的新抗原自然多不了,肿瘤里浸润的免疫细胞也很少。就算用免疫检查点抑制剂把免疫系统的束缚解除,免疫细胞也无法有效地识别、杀伤肿瘤细胞。
这种情况下,让免疫细胞能认出肿瘤细胞就变得至关重要了。对此,美国和德国的科学家不约而同地想到了癌症疫苗。
此前,这两个团队都曾经用癌症疫苗治疗过黑色素瘤,取得了不错的效果。德国的研究中,13位黑色素瘤患者有8人的肿瘤完全消失,且23个月内未复发。美国的研究中,6位患者中也有4人的肿瘤完全消失,32个月内未复发。

虽说之前在黑色素瘤中成功了,这次在胶质瘤中的试验挑战还是不少的。毕竟胶质瘤突变负荷低,可供选择的新抗原也少。
为了解决这一问题,德国的研究人员先从30个胶质瘤中,识别出了59个要么非常常见,要么肿瘤特异性很好的非突变抗原,构建了一个抗原库。从中选出了激活T细胞效果最好的10个多肽,作为第一支疫苗(APVAC1)。
同时,研究人员还在每位患者的肿瘤细胞中,寻找那些可以与HLA-1类分子结合,免疫原性高的突变多肽,制成第二支疫苗(APVAC2)。
 德国团队的负责人Wolfgang Wick
德国团队的负责人Wolfgang Wick
在胶质瘤患者手术切除肿瘤,并进行标准放化疗后,在患者进行替莫唑胺辅助化疗时,给患者注射APVAC1和APVAC2疫苗,并同时注射粒细胞巨噬细胞集落刺激因子(GM-CSF)和多聚ICLC作为佐剂,以增强免疫反应。
试验中,有15人注射了APVAC1,其中11人还注射了APVAC2。
在注射了APVAC1的患者中,92.3%至少对其中一种抗原肽产生了CD8+T细胞的免疫应答,血液中相应的特异性CD8+T细胞数量增加,出现记忆表型。而注射了APVAC2的患者中,80%出现了新抗原特异性CD4+T细胞的应答,主要表现为Th1型应答。
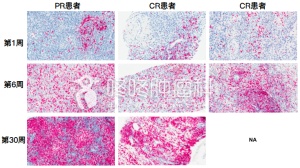
最终,这15名患者的中位总生存期达到了29个月,无进展生存期也达到了14.2个月。其中一位患者甚至生存了超过38.9个月,在他于26.8个月时切除的复发肿瘤中,研究人员发现了大量的T细胞浸润。癌症疫苗成功地把他的“冷肿瘤”变热。

而在美国的研究中,研究人员还发现,只有没使用过地塞米松的2名患者,对癌症疫苗产生了良好的响应。在复发后切除的肿瘤中,也只有这两名患者的肿瘤组织里有大量的T细胞浸润。这两名患者肿瘤浸润的T细胞中,几乎所有CD8+ T细胞都表达了细胞毒性标志物,CD4+T细胞也有1/3表达细胞毒性标志物,很少表达Treg标志物。
地塞米松经常用于治疗颅内肿瘤引起的脑水肿,同时它还是一种强力的免疫抑制剂。研究人员认为地塞米松使得患者全身的幼稚T细胞和记忆T细胞衰竭,这才让用过地塞米松的患者对癌症疫苗响应不好。并建议胶质瘤患者使用bevacizumab治疗脑水肿。
 美国团队的试验流程
美国团队的试验流程
通过对肿瘤浸润T细胞TCR的分析,研究人员还证明了肿瘤中浸润的T细胞正是癌症疫苗诱导的新抗原特异性T细胞。在外周诱导出的T细胞可以穿过血脑屏障,到达颅内的病灶!
“这是首次有证据表明,一种疫苗可以产生针对肿瘤的免疫细胞,并从血液运输到胶质母细胞瘤里。”达纳-法伯癌症研究所神经肿瘤中心临床主任 David Reardon说。
Reardon还表示下一步是把癌症疫苗和免疫检查点抑制剂联用:“这样可以免疫反应从分子刹车中释放出来,以便T细胞能够对肿瘤做出更强烈的反应。免疫检查点抑制剂和新抗原疫苗有望具有协同作用,从而产生更强的抗肿瘤免疫反应。”
参考文献:
1. https://www.nature.com/articles/s41586-018-0810-y
2. https://www.nature.com/articles/s41586-018-0792-9
3. Ostrom Q T, Gittleman H, Truitt G, et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011–2015[J]. Neuro-oncology, 2018, 20(suppl_4): iv1-iv86.
4. Snyder A, Makarov V, Merghoub T, et al. Genetic basis for clinical response to CTLA-4 blockade in melanoma[J]. New England Journal of Medicine, 2014, 371(23): 2189-2199.
5. Rizvi N A, Hellmann M D, Snyder A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non–small cell lung cancer[J]. Science, 2015, 348(6230): 124-128.
6. Schumacher T N, Schreiber R D. Neoantigens in cancer immunotherapy[J]. Science, 2015, 348(6230): 69-74.
本文仅供医学药学专业人士阅读







-1.jpg-pd13)
-1-scaled.jpg-pd13)
.jpg-pd13)













 X
X