2018年诺贝尔医学或生理学奖颁给了为免疫抗癌疗法做出巨大贡献的两位科学家——James P.Allison和Tasuku Honjo,以表彰他们发现PD-1和PD-L1的重要相互关系。随着PD-1和PD-L1研究发现的进一步深入,研究人员发现了在肿瘤领域的广泛应用。但研究人员并没有因此罢休,来自Eric Vivier教授领导的研究团队发现,机体内的T细胞和NK细胞表面均含有NKG2A分子,其与其他细胞表面的配体结合后也可产生显著的“免死”机制。其最新的研究进展发表于最近的《Cell》杂志。
首先,我们来分别了解一下“警察”、“叛乱分子”和“免死金牌”。人体自身存在免疫“警察”—T细胞。这些T细胞随着人体的血液、淋巴液等体液对全身的组织器官进行免疫检测,一旦发现有病毒、细菌或者坏死组织细胞,T细胞会立即启动免疫清除机制,将这些“叛党”清除掉。
而这里的“叛党”包括病毒、细菌以及我们所熟知的肿瘤细胞。但这里也有一个十分奇妙的机制,T细胞是如何分辨机体自身的“良民”还是其他“叛乱分子”呢?原来,当T细胞接触组织细胞时,他们会向T细胞展示出“免死金牌”——PD-L1,其与免疫细胞表面的PD-1结合后,则告诉免疫系统“此乃良民,大可放行”。

但是身体内的肿瘤细胞也发现了这一奇特的“免死”机制,肿瘤细胞本身也会表达PD-L1配体,当T细胞的PD-1与其结合后,也会产生“免死效应”。因此,这些肿瘤细胞会逃避最有效的抗癌机制,即人体自身的免疫系统。此后开发的针对PD-L1的靶向抗癌药物则是利用了这一免疫机制,将抗PD-L1抗体注射入机体,中断这一“免死机制”,这使得免疫细胞能够尽全力查杀肿瘤细胞。

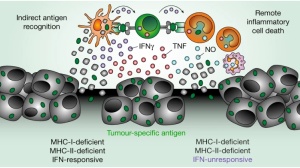
此次,Eric Vivier教授领导的研究团队发现,机体内的T细胞和NK细胞表面均含有NKG2A分子,其与其他细胞表面的配体结合后也可产生显著的“免死”机制。就像PD-L1受体阻断剂一样,我们是否可以利用这一机制研发新型的抗癌机制呢?Eric Vivier教授的研究团队开发出名为Monalizumab的单抗。这种单抗可以有效阻断NKG2A分子与其配体结合,进而启动T细胞和NK细胞对肿瘤细胞的查杀作用。
这仅仅在理论层面具有抗癌作用,那么究竟是否有效呢?该研究团队设立了4个实验组,分别研究了单独使用PD-L1单抗、单独使用NKG2A单抗、联合使用PD-L1和NKG2A单抗以及空白Control组。令研究者大吃一惊的是,单独使用NKG2A单抗竟然没有显著的抗癌作用,而单独使用PD-L1单抗则可减少40%的肿瘤组织,但是当联合使用PD-L1和NKG2A单抗时,则可减少75%的肿瘤组织!

在进行完小鼠试验后,研究人员进行了人体实验,首先他们筛选了31名鳞状细胞头颈癌患者,对其进行了分组,分别使用了不同剂量的NKG2A单抗以及EGFR受体抑制剂cetuximab。最终这31名患者中,8名患者有超过30%的肿瘤减少,14名患者病灶减少50%,病情得到有效缓解,甚至一名患者病灶完全消失了!

这项研究最核心的部分在于其发现了新型“免死金牌”——NKG2A分子,并探索了其内在的作用机制,且利用单抗阻断该分子后验证了其确实存在抗肿瘤特性,同时,研究人员还采用小规模人体实验测试了该分子单抗初步的临床效果,其结果同样令人惊喜。这项研究为接下下来的大规模临床实验和更为深入的基础研究奠定了理论基础。相信在不久的未来,将迎来全新的免疫激活剂的上市。
参考文献
Emilie Narni-Mancinelli, Roger B. Cohen.Eric Vivier Anti-NKG2A mAb Is a Checkpoint Inhibitor that Promotes Anti-tumor Immunity by Unleashing Both T and NK Cells
本文仅供医学药学专业人士阅读







-1.jpg-pd13)
-1-scaled.jpg-pd13)
.jpg-pd13)













 X
X