昨日,美国药品监督管理局(FDA)授予PD-1抗体K药联合乐伐替尼,“突破性新药”资格认定。有了这个“丹书铁券”在手,该组合方案在未来临床试验、审批上市等诸多环节,都会获得FDA的优待和绿色通道。
PD-1抑制剂联合抗血管生成药物,目前已经有不少组合方式:PD-1抗体联合乐伐替尼、PD-1抗体联合卡博替尼、PD-L1抗体联合贝伐、PD-L1抗体联合阿昔替尼,都有不俗的初步数据(详见:PD-1联合治疗: 肿瘤控制率逼近100%,更多相关文章可在APP内搜索“PD-1联合治疗”或“联合治疗”)。
其中,PD-1抗体联合乐伐替尼,一共公布过三次数据。
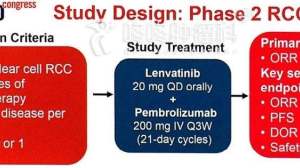
第一次,是用于晚期肾癌。一共30位患者,12位患者一线治疗,其余是二三线治疗。30位患者接受联合治疗后,19位肿瘤明显缩小,有效率63%;9位患者肿瘤稳定不长大,疾病控制率96%。其中,12位一线治疗的患者,10位患者肿瘤明显缩小,有效率83%;2位患者肿瘤稳定,疾病控制率100%。因此,这次FDA也正是基于这份数据,给予了PD-1抗体K药联合乐伐替尼用于晚期肾癌治疗的“突破性疗法认定”。PS:该联合疗法的副作用主要是:腹泻,疲劳,甲状腺功能减退等。

第二次,是跨癌种的一期临床试验。一共招募了13名晚期癌症患者(2名非小肺癌、8名肾癌、2名子宫内膜癌和1名恶性黑色素瘤),7位肿瘤明显缩小,有效率54%;6位患者肿瘤稳定,总的疾病控制率100%。

第三次,是子宫内膜癌。这是一个Ib/II期临床试验,一共招募了23位至少接受过一种其他治疗失败的晚期子宫内膜癌患者。11位病友肿瘤明显缩小,有效率48%;此外,还有11位患者肿瘤稳定,总的疾病控制率96%。联合方案的副作用主要是:高血压、疲劳、关节痛、腹泻和恶心等。

目前,PD-1抗体K药联合乐伐替尼,一共有4项临床试验正在进行中,还在活跃地招募志愿者。其中1个是肝癌的一期临床试验,规模较小;另外3个均为二、三期临床试验,蔚为壮观。
第一个,乐伐替尼联合PD-1抗体或者乐伐替尼联合依维莫司,挑战索坦在晚期肾癌中的一线治疗地位。
这是一个全球117家医院(亚洲地区主要是韩国的7家医院)参与的大型国际多中心三期临床试验,详见:https://clinicaltrials.gov/ct2/show/NCT02811861?recrs=a&type=Intr&cond=lenvatinib&rank=10
晚期肾癌,截止目前,舒尼替尼(也就是索坦)依然是首选治疗,虽然卡博替尼已经后来居上,但是毕竟刚刚开始。因此,各种其他组合方案,跃跃欲试,想要挑战索坦的地位。乐伐替尼这次,是双保险。乐伐替尼联合K药,乐伐替尼联合依维莫司,都有潜力,和索坦一决高下。
第二个,乐伐替尼联合K药治疗胃食管癌。这是一个二期临床试验,一个全新的尝试,暂无特别的数据支持。
地点在美国纽约大学医学院,详见:https://clinicaltrials.gov/ct2/show/NCT03321630?term=PD-1&cond=lenvatinib&rank=1
第三个,是一个跨癌种的I/II期临床试验。计划招募125名志愿者,主要的癌种是:非小细胞肺癌、肾癌、子宫内膜癌、尿路上皮癌、头颈部鳞癌以及恶性黑色素瘤。
临床试验的地点在美国和西班牙(主要是美国)的55家医院,详见:https://clinicaltrials.gov/ct2/show/NCT02501096?recrs=a&type=Intr&cond=lenvatinib&rank=8
本文仅供医学药学专业人士阅读








-1.jpg-pd13)
-1-scaled.jpg-pd13)
.jpg-pd13)












 X
X