2017年,美国FDA破纪录的批准了46个新药上市。其中,肿瘤药领域最具有划时代意义的批文是如下两个:
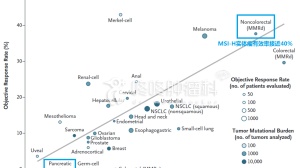
其一,2017年5月批准PD-1抗体K药用于所有dMMR/MSI-H的实体瘤(详见:史无前例,一网打尽:PD1批准用于所有dMMR实体瘤),这是FDA批准的首款不按照肿瘤来源,而是直接按照生物标志物就可以使用的抗癌药物,不管是肠癌、胆管癌、胃癌还是食管癌,只要经过检测,属于MSI-H/dMMR类型,就可以考虑用PD-1抗体K药进行治疗,这是历史性的进步。
其二,2017年8月和2017年10月,美国FDA批准了两款免疫细胞治疗CAR-T技术上市,分别用于治疗急性淋巴细胞白血病和非霍奇金淋巴瘤。CAR-T技术融合了免疫治疗、细胞治疗和基因治疗的三重突破,是一种活的细胞产品,进入病人体内后可以自主的繁殖和扩增,是一种全新意义上的抗癌产品。以前上市的不管是化疗药、小分子抑制剂还是大分子单抗,毕竟都是药企在生产车间里生产好的、规格和性质均一稳定的药品;CAR-T则是活的细胞,不同的病人都要私人订制,而且到了病人体内后还可以自主地扩增、繁殖和活化,是完全不同的一类新药新技术(详见:里程碑:全球首个CAR-T细胞疗法上市在即,有效率高达83%!)。

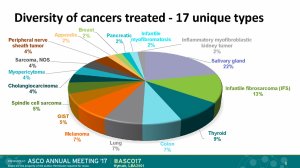
和第一个思路不谋而合,2017年另外一个闪亮全场的广谱抗癌靶向药是NTRK抑制剂Larotrectinib。这个新药在2017年6月召开的美国临床肿瘤学大会上,宣布了一项小规模临床试验结果:55位NTRK基因融合突变的患者(包括肺癌、肠癌、黑色素瘤、肉瘤、胃肠间质瘤和甲状腺癌等13种肿瘤),接受Larotrectinib,100mg每天2次治疗后,42位患者肿瘤缩小超过30%,有效率76%,包括12%的患者肿瘤完全消失(详见:13种癌、老幼通吃、有效率76%: 新药Larotrectinib显身手)。这么劲爆的疗效,引得众多超级大药企垂涎欲滴、纷纷希望收购这家创新药企;美国FDA也宣布给予这个新药突破性疗法资格认定……
但是这些,距离病友都太遥远了,病友们最关心的问题是,这个药如何才能用上。近日,研发Larotrectinib的公司宣布启动三项全新的临床试验:

- 第一项临床试验,是一个I期临床试验,计划招募NTRK融合突变的成人(18岁以上)晚期癌症患者,计划招募108名志愿者。
- 招募机构主要是美国的8家顶尖医院,详见:https://clinicaltrials.gov/ct2/show/NCT02122913?cond=NCT02122913&rank=1
- 第二项临床试验,是一个I/II期临床试验,计划招募的是NTRK融合突变的儿童和青少年(21岁以下)患者,计划招募84名志愿者。
- 临床试验的地点是美国的10家顶尖医院,以及澳大利亚、法国、意大利、德国、西班牙的几家医院,详见:https://clinicaltrials.gov/ct2/show/NCT02637687?cond=NCT02637687&rank=1
- 第三项临床试验,是一个II期临床试验,计划招募的是NTRK融合突变的青少年和成年(大于12岁)患者,计划招募151名志愿者。
- 临床试验的地点在欧美、韩国以及新加坡等国的36家医院,详见:https://clinicaltrials.gov/ct2/show/NCT02576431?cond=NCT02576431&rank=1
有效率近80%的广谱抗癌神药,如果基因检测发现自己有NTRK融合突变的病友,千万不要犹豫,赶紧去联系上述的机构,获取免费的临床试验机会哦。如有困惑,也欢迎咨询咚咚肿瘤科的客服和专家团队。
参考文献:
[1]http://www.onclive.com/publications/oncology-live/2017/vol-18-no-24/threepronged-program-investigates-larotrectinib-in-diverse-patient-population
[2]Hyman DM, Laetsch TW, Kummar S, et al. The efficacy of larotrectinib (LOXO-101), a selective tropomyosin receptor kinase (TRK) inhibitor, in adult and pediatric TRK fusion cancers. J Clin Oncol. (suppl 36; abstr LBA2501). meetinglibrary.asco.org/ record/144598/abstract.
本文仅供医学药学专业人士阅读









-1.jpg-pd13)
-1-scaled.jpg-pd13)
.jpg-pd13)














 X
X