5月24日,美国FDA批准PD-1抑制剂Keytruda用作治疗带有微卫星不稳定性高(microsatellite instability-high,MSI-H)或错配修复缺陷(mismatch repair deficient,dMMR)的不可切除或发生转移的所有实体瘤患者。这是FDA批准的首个参照生物标志物,而非参照肿瘤发生位置的广谱抗癌药物,成为临床肿瘤治疗理念的重大突破!
今年的ASCO,另外一家医药公司Loxo呈现的核心在研药物Larotrectinib(LOXO-101)的早期临床数据又一次惊艳全场。

缓解数据:
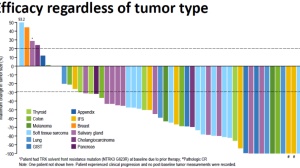
在3项共纳入55名患者(43名成人,12名儿童)的小型研究中,LOXO-101取得了76%的缓解率,包括12%的完全缓解和64%的部分缓解。

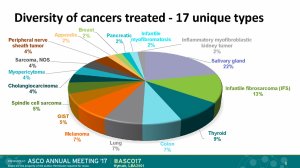
此次让人震惊的是,这55例患者共涉及17种不同类型的肿瘤,在肺癌、乳腺癌、胆管癌、结直肠癌、肾癌、膀胱癌、胃癌等中都取得了相似的疗效数据。

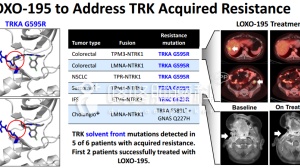
它的“套路”与上个月的Keytruda获批相似,LOXO-101也是作为一款广谱肿瘤药来开发,拟用于所有表达有原肌球蛋白受体激酶( tropomyosin receptor kinase,TRK)的肿瘤患者,而不依据患者肿瘤的解剖位置。
生存数据:
或许有人说,缓解率不是检验药物效果的金标准。生存数据方面,长期随访的中位疾病缓解时间和无进展生存期还未达到,6个月中位疾病缓解时间为91%。

75%的入组患者,以及发生缓解的93%的患者,目前仍在接受LOXO-101治疗或已接受根治手术。Loxo公司CEO Joshua H. Bilenker指出,LOXO-101目前治疗失败的患者很少,一些产生应答的患者已经治疗了2年以上。

安全性数据:
LOXO-101最常见的不良事件包括疲乏、头晕、恶心、贫血、呕吐等。7例(13%)患者因为不良事件而降低剂量,但这7例患者肿瘤都要减小(1名完全缓解、5名部分缓解、1名疾病稳定),没有患者因为不良事件中止治疗。

上市计划:
Loxo是一家基于基因突变开发广谱肿瘤新药的公司,LOXO-101在2015年3月开始治疗第一名患者;2016年7月13日被FDA授予突破性药物资格,用于TRK融合基因突变阳性的成人及儿童的不可手术切除或转移性实体瘤;2017年2月完成关键入组。
野心勃勃的Loxo公司甚至计划凭借这些早期临床数据在2017年底或2018年初向FDA提交上市申请,寻求加速批准并于2018年上市。
在针对TRK融合基因突变阳性方面,另一家公司Ignyta同样针对TRK融合基因突变阳性的 entrectinib已处于II期阶段,并且在2017年5月15日同样被FDA授予突破性疗法资格。

小编快评:
10多年前,肿瘤驱动基因突变的发现让我们逐渐进入了同癌异治的个体化治疗,而转眼间,临床医学工作者以及制药公司的努力又带领我们领略异癌同治的神奇世界。愿癌症宣战的鸿愿不仅停留于口号,愿向“让癌症成为慢性病”的宏伟壮志早日实现!
本文仅供医学药学专业人士阅读























 X
X