…接上文
14 临床研究
14.1 无法切除或转移性黑色素瘤
试验 1 是一项多中心、开放性试验,将患有无法切除或转移性黑色素瘤的患者随机分配 (2: 1),接受每 2 周静脉输注一次 OPDIVO 3 mg/kg,或接受试验主持人选择的化学治疗,包括每 3 周一次 dacarbazine 1000 mg/m2,或每 3 周一次 carboplatin AUC 6 并用每 3 周一次 paclitaxel 175 mg/m2。患者必须符合的条件为接受 ipilimumab 与 BRAF 抑制剂(若为 BRAF V600 突变阳 性)期间或之后出现疾病恶化。该试验排除具有以下病况的患者:自体免疫疾病、需要使用全 身性免疫抑制药物的病症、眼部黑色素瘤、活动性脑转移,或曾发生 ipilimumab相关第4级不良反应(内分泌病变除外)或发生 ipilimumab相关第3级不良反应且于事件起始后 12 周内未获 缓解或未获适当控制。肿瘤评估在随机分配后 9 周进行,接着第一年每 6 周评估一次,之后为 每 12 周评估一次。
在一项单组、非比较性、预定期中分析中,对试验 1 中接受 OPDIVO 治疗且至少追踪 6 个月 的前 120 名患者进行疗效评估。此族群中的主要疗效结果指标为由盲性独立中央审查采用实体 肿瘤反应评估标准(RECIST1.1)所测得的确定客观反应率(ORR)和反应时间。
在接受 OPDIVO 治疗的 120 名患者中,年龄中位数为 58 岁(范围:25 至 88 岁),65%患者为男 性,98%为白人,而 ECOG 体能状态分数为 0 分(58%)或 1 分 (42%)。疾病特征为 M1C 疾病 (76%)、BRAF V600 突变阳性(22%)、LDH 升高(56%)、脑转移病史(18%)以及曾接受两种(含) 以上的全身性疗法以治疗转移性疾病(68%)。
接受 OPDIVO 治疗者的客观反应率(ORR)为 32% (95%信赖区间[CI]:23%,41%),包括 4 例完 全反应和 34 例部分反应。38 名出现反应的患者中,33 名患者(87%)有持续反应,反应时间范 围为 2.6+至 10+个月,其中包括 13 名患者的持续反应时间达 6 个月(含)以上。
无论患者是否罹患 BRAF V600 突变阳性黑色素瘤,均观察到客观反应。
试验 3 是一项多中心、随机双盲试验,将患有无法切除或转移性 BRAF V600 野生型(wild-type) 黑色素瘤的患者随机分配(1:1)到接受每 2 周静脉输注一次 OPDIVO 3 mg/kg,或每 3 周静脉 输注一次 dacarbazine 1000 mg/m2,直到疾病恶化或发生无法接受的毒性。随机分配是以 PD-L1 的状态(以免疫组织化学法做肿瘤细胞膜染色,≥5%肿瘤细胞表现相较于<5%或不确定结果)和 M 分期(M0/M1a/M1b 相较于 M1c)做分层随机。主要纳入条件包括:经组织学确认的无法切除或转移性,皮肤、黏膜或肢端的黑色素瘤;先前没有接受针对转移性疾病的治疗;在随机分配 前至少 6 周完成的前的辅助性(adjuvant)或前导性治疗(neoadjuvant);ECOG 体能状态分数为 0 分或 1 分;没有自体免疫疾病;没有进行性脑部或软脑膜转移。此试验排除眼部黑色素瘤的患 者。于随机分配后 9 周开始进行肿瘤评估,第一年每 6 周评估一次,之后每 12 周评估一次。
此试验的主要疗效结果指标为整体存活期(OS)。其他疗效结果指标包括由试验主持人依据 RECIST1.1 版评估的无恶化存活期(PFS)和客观反应率(ORR)。
共 418 名患者随机分配至 OPDIVO 组(210 名)或 dacarbazine 组(208 名)。年龄中位数为 65 岁 (范围:18 至 87 岁),59%为男性,99.5%为白人。疾病特征为 M1C分期的疾病(61%)、皮肤黑 色素瘤(74%)、黏膜黑色素瘤(11%)、LDH 升高(37%)、有 PD-L1≥5%肿瘤细胞表现(35%)、脑转 移病史(4%)。在 OPDIVO 组有更多患者的 ECOG 体能状态分数为 0 分(71%相较于 58%)。
根据整体存活期的期中分析(占所有预定事件数的 47%),试验 3 证实了随机分配至 OPDIVO 治 疗组的患者相较于 dacarbazine 治疗组患者,在整体存活期(OS)上具有统计意义的显着改善。 表 8 和图 1 汇整了这些疗效结果。
表 8:疗效结果﹣试验 3
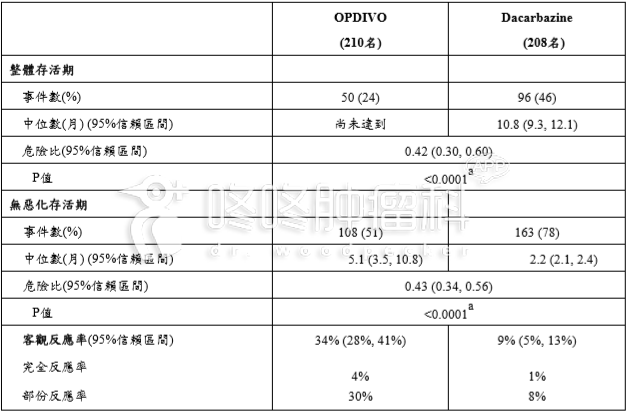
a. p 值在期中分析上是与α值 0.0021 作比较。
图 1:整体存活期的 Kaplan-Meier 曲线﹣试验 3
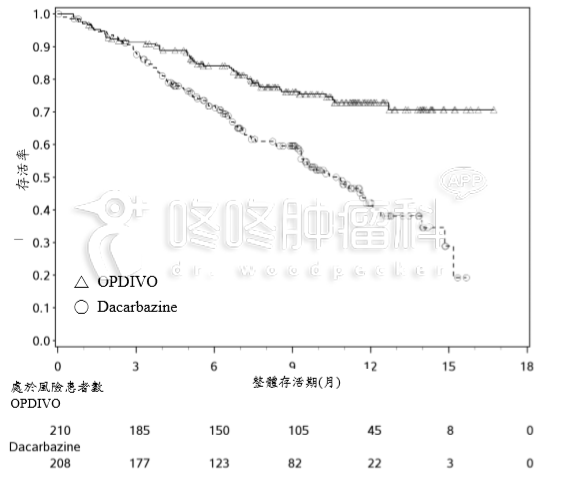
在分析的时候,有 88﹪接受 OPDIVO 的患者(72 名中有 63 名)有持续反应,其中有 43 名患者 反应持续时间达 6 个月或更久。
14.2 转移性鳞状非小细胞肺癌
试验 2 是一项随机分配(1:1)、开放性试验,纳入 272 名曾在接受一种含铂双药化学治疗期间 或之后出现疾病恶化的转移性鳞状非小细胞肺癌患者。患者接受每 2 周静脉输注一次 OPDIVO 3 mg/kg (135 名),或每 3 周静脉输注一次 docetaxel 75 mg/m2 (137 名)的治疗。本试验所纳入 患者不考虑 PD-L1 的状态。此项试验排除患有自体免疫疾病、症状性间质性肺病或未经治疗 脑转移的患者。先前已接受脑转移治疗的患者可符合资格,只要在纳入前至少 2 周的神经学检 查恢复至基期状态,且皮质类固醇已停用或者使用稳定或减少剂量为<10 mg/day prednisone 或 等效剂量的皮质类固醇。第一次肿瘤评估在随机分配后 9 周进行,之后持续每 6 周评估一次。 主要疗效结果指标为整体存活期(OS)。其他疗效结果指标包括由试验主持人评估的客观反应率 (ORR)与无恶化存活期(PFS)。
试验 2 中,患者年龄中位数为 63 岁(范围:39 至 85 岁),其中 44% ≥65 岁及 11% ≥75 岁。大 多数患者为白人(93%)和男性(76%)。族群基期疾病特性为第 IIIb 期(19%)、第 IV 期(80%)与脑部转移(6%)。基期 ECOG 体能状态分数为 0 分(24%)或 1 分(76%)。
依据本试验预先设定的期中分析(当观察到 199 起事件发生时,占最终分析预定事件数的 86%) 结果显示,随机分配至 OPDIVO 治疗组的患者相较于 docetaxel 治疗组患者在整体存活期(OS) 上为具有统计意义的显着改善 (表 9 和图 2)。
表 9:试验 2 的疗效结果(意图治疗分析)
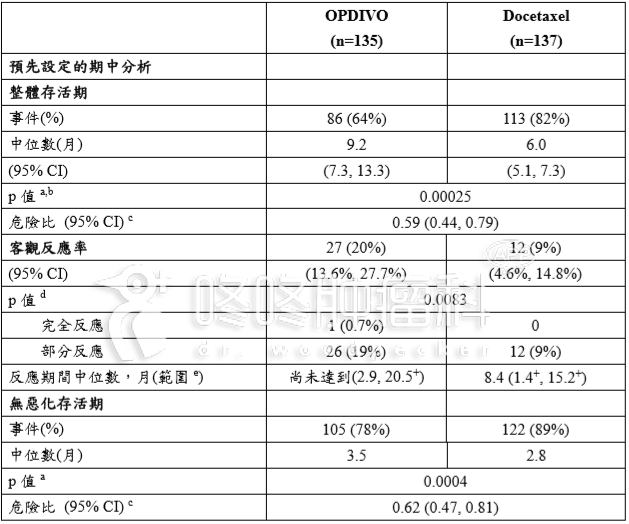
a 依据分层对数等级检定。
b 将 p 值与为本项期中分析分配的 α 值 0.0315 比较。
c 取自分层 Cox 比例危险模型。
d 依据分层 Cochran-Mantel-Haenszel 检定。
e 符号+表示设限值。
图 2: 整体存活期 – 试验 2

16 供应/储存和处理方式
OPDIVO® (nivolumab)的供应方式:20 mg/2 mL 单次使用小瓶及 100 mg/10 mL单次使用小瓶。
OPDIVO 应冷藏储存于 2℃-8°C (36°F-46°F)。OPDIVO 使用前应避光储存,并存放于原包装 中。请勿冷冻或摇晃。
17 患者咨询资讯
应告知患者有发生免疫媒介性不良反应的风险,这可能需要使用皮质类固醇治疗及中断或停用 OPDIVO,包括:
● 肺炎:若有任何新出现的咳嗽、胸痛或呼吸急促,或前述症状恶化,建议患者立即联络其医疗照护提供者[ 请参阅警语及注意事项 ( 第 5.2 节 )]。
● 结肠炎:若出现腹泻或严重腹痛,建议患者立即联络其医疗照护提供者[ 请参阅警语及注意事项 ( 第 5.3 节 )]。
● 肝炎:若出现黄疸、严重恶心或呕吐、右侧腹部疼痛、昏昏欲睡或容易瘀青或出血,建议患者立即联络其医疗照护提供者[ 请参阅警语及注意事项 ( 第 5.4 节 )]。
● 内分泌病变:若出现脑下垂体炎、肾上腺功能不全、甲状腺功能低下症、甲状腺功能亢进症及糖尿病的征兆或症状,建议患者立即联络其医疗照护提供者 [ 请参阅警语及注意 事项 ( 第 5.5 节 )]。
● 肾炎和肾功能不全:若出现肾炎的征兆或症状,包括尿量减少、血尿、脚踝肿胀、食欲不 振,及任何其他的肾功能不全症状,建议患者立即联络其医疗照护提供者[ 请参阅警语及 注意事项 ( 第 5.6 节 )]。
● 皮疹:若出现皮疹,建议患者立即联络其医疗照护提供者[ 请参阅警语及注意事项 ( 第 5.7 节 )]。
● 脑炎:若出现脑炎的神经学征兆或症状,建议患者立即联络其医疗照护提供者 [ 请参阅警 语及注意事项 ( 第 5.8 节 )]。
● 输注反应:应告知患者有发生输注反应的潜在风险[ 请参阅警语及注意事项 ( 第 5.10 节 )]。
● 具有生育能力的女性:应告知具生育能力的女性有关本品对胎儿的潜在风险,并在确定或疑似怀孕时告知其医疗照护提供者 [ 请参阅警语及注意事项 ( 第 5.11 节 ) ,特殊族群的使用(8.1)]。建议具生育能力的女性在 OPDIVO 治疗期间及至 OPDIVO 最后一剂给药后至少 5 个月,采取有效的避孕措施 [ 请参阅特殊族群的使用 ( 第 8.3 节 )] 。
● 哺乳:应告知妇女在接受 OPDIVO 治疗期间不得进行哺乳 [ 请参阅特殊族群的使用( 第8.2节 )]。
— THE END —
本系列共有6篇文章,在首页搜索栏中输入“opdivo”,一次看全所有内容。
本文仅供医学药学专业人士阅读






















 X
X