日前,罗氏(Roche)宣布美国FDA已经接受该公司的补充生物制剂许可申请(sBLA),并授予其重磅免疫疗法Tecentriq(atezolizumab)优先审评资格,与Avastin (bevacizumab)、紫杉醇和卡铂(化疗)联用,初始(一线)治疗转移性非鳞状非小细胞肺癌(NSCLC)患者。FDA预计将在今年9月5日之前作出批准决定。

据美国癌症协会(ACS)估计,2018年将有超过23万名美国人被诊断为肺癌,其中NSCLC占85%。据估计,美国约有60%的肺癌诊断时已是晚期阶段。这些患者的预后情况不容乐观,急需新的有效治疗来缓解疾病,延长生命。
Tecentriq是一款抗PD-L1单抗,可以与肿瘤细胞和肿瘤浸润免疫细胞上的PD-L1结合,阻断其与PD-1和B7.1受体的作用,从而重新激活T细胞,击杀癌细胞。它目前已在美国获批治疗尿路上皮癌和NSCLC。Tecentriq加Avastin的治疗方案可能增强免疫系统对付广泛癌症的潜力,包括一线治疗晚期NSCLC。Avastin除了其确定的抗血管生成作用外,还可以通过抑制VEGF相关的免疫抑制,促进T细胞肿瘤浸润,并激活针对肿瘤抗原的T细胞应答,从而进一步增强Tecentriq的效果。

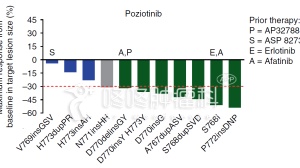
此次sBLA的提交是基于多中心、开放标签、随机、对照3期临床研究IMpower150的结果。该研究评估了Tecentriq联合Avastin、紫杉醇和卡铂治疗IV期非鳞癌NSCLC患者的疗效和安全性,这些患者未曾受过化疗治疗晚期疾病。该研究共招募了1,202人,其中具有ALK和EGFR突变的患者被排除在主要意向治疗(ITT)分析之外。
结果显示,该研究符合其在晚期非鳞状NSCLC患者初始治疗中的总生存期(OS)和无进展生存期(PFS)的共同主要终点。该组合疗法的安全性特征与各种药物的安全性特征一致,并且没有发现新的安全性信号。

“我们的3期临床试验结果显示,Tecentriq联合Avastin、紫杉醇和卡铂可能为转移性非鳞状非小细胞肺癌的初始治疗提供显著的生存益处,”罗氏首席医学官兼全球产品开发负责人Sandra Horning博士说:“我们正在与FDA密切合作,尽快为这类肺癌患者提供这一治疗方案。”
参考资料:
[1] FDA grants priority review to Roche’s cancer immunotherapy TECENTRIQ (atezolizumab) for initial treatment of people with a specific type of metastatic lung cancer
[2] AACR | 罗氏Tecentriq组合疗法显著改善肺癌无进展生存期
本文仅供医学药学专业人士阅读
























 X
X