作者:王俊
来源:知识分子
编者按:
2017年1月16日,耶鲁大学陈列平教授在中科院生物物理所做了一场“贝时璋讲座”报告,并获得中国生物物理学会颁发的最高荣誉奖——“贝时璋奖”,以表彰其在癌症免疫治疗领域所作的开拓性贡献。值得注意的是,2016年诺贝尔生理与医学奖获得者大隅良典2015年也获得这一奖项。在PD-1/PD-L1药物研发过程中,陈列平的一系列工作不管是在理论、基础研究、还是临床应用上都发挥了至关重要的作用。鉴于学术界和工业界比较普遍的对PD-1/PD-L1药物的研发过程缺乏足够了解,陈列平在美国耶鲁大学研究室的王俊博士撰文厘清PD-1/PD-L1药物的研发历史,并着重分析这一药物对今后的肿瘤免疫药物研发带来的启示。
撰文 | 王俊(耶鲁医学院免疫系肿瘤中心副研究科学家)
责编 | 叶水送
PD-1/PD-L1药物研发带来的启示
PD-1/PD-L1抗体的药物研发是人类征服肿瘤历史上的一个关键突破。这些药物的抗肿瘤机制不同于以往的任何药物,既不是单纯地针对肿瘤,也不是简单地调节免疫细胞,而是特异性地针对肿瘤微环境中关键免疫逃逸机制,通过改善肿瘤免疫微环境来控制和清除肿瘤;所以这种疗法的研发成功将肿瘤免疫推向前所未有的高度,而且为今后的肿瘤免疫基础以及临床研究带来了巨大的革新以及深远影响。
目前,这种疗法在美国、欧洲以及日本均得到批准,在中国的临床试验也已经开始。它在多种肿瘤治疗中疗效显著,并且效果稳定,副作用比较小,很多肿瘤病人受益其中。作为在肿瘤免疫领域耕耘十多年的一线科研工作者,笔者着重想厘清PD-1/PD-L1抗体药物研发历史的几个关键节点,并且讨论以下两个问题:
1. PD-1/PD-L1药物是怎么研发出来的?
2. PD-1/PD-L1药物特点以及对今后的抗肿瘤药物研发的启示?
PD-1/PD-L1药物研发史
PD-1/PD-L1药物研发得益于对肿瘤和免疫系统的深刻理解。肿瘤来源于机体自身细胞的突变和恶性增殖;而且这些特征大多是不稳定和异质(heterogeneous)的;所以单纯的针对肿瘤本身的疗法,不管是化疗,放疗,还是后来的肿瘤靶向治疗,在临床治疗上效果并不佳。要么是特异性差,副作用大;要么是只能控制一部分肿瘤,药物治疗后很快导致耐药以及更加恶性的肿瘤产生;所以多年来很少有药物能真正提高病人生存期或者彻底清除肿瘤。
免疫细胞特别是T细胞时刻监视外在致病原以及机体细胞的改变,并且通过独特的特异性调节机制在肿瘤发生发展的长期过程中,起着很关键的控制作用。所以,从某种角度上讲,机体的免疫细胞和肿瘤一起进化发展,具备识别自身肿瘤的特异性以及消除肿瘤的能力。但是由于种种原因,免疫细胞失去了对肿瘤的控制能力,导致了肿瘤的发生。了解这种肿瘤与免疫系统之间的关键免疫逃逸机制,是了解PD-1/PD-L1药物研发的关键。
陈列平自1990年初就提出了肿瘤微环境存在免疫逃逸关键分子的假说,也一直孜孜不倦地寻找这样的分子来用于肿瘤治疗。陈列平于20世纪80年代从肿瘤临床领域果断转向基础免疫学研究。那个年代,免疫学家已经开始运用一些细胞膜表面分子来对免疫细胞进行分群。但是这些免疫细胞,特别是T细胞是如何活化的,免疫学家却不是特别清楚,所以期望对细胞的活化以及调控有更深的了解。当时很多科学家企图通过对免疫细胞膜受体的发现和鉴定来对免疫细胞的分子调节机制进行更深入的了解,不少科学家通过产生抗体,消减杂交等手段来企图发现一些对免疫调节重要的分子。在这个过程中,共刺激分子(co-stimulatory molecules) CD28、CTLA-4以及其配体B7的发现是关键事件,印证了Peter Bretscher于1970年提出的淋巴细胞双信号假说:即T细胞活化除了抗原/TCR介导的第一信号外,还依赖B7配体/ CD28&CTLA-4受体等共刺激分子途径介导的第二信号。

► 当细胞毒T细胞上的PD-1分子与肿瘤细胞表面的PD-L1配体结合时,肿瘤细胞能逃脱免疫系统的杀伤,图片节选自Nature Video
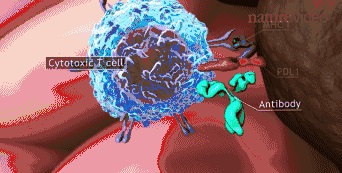
► 当细胞毒T细胞上的PD-1分子与抗体结合时,免疫细胞能识别肿瘤细胞,从而对其进行杀伤,图片节选自Nature Video
陈列平在西雅图的BMS(百时美施贵宝)药物研究所的工作是历史上第一次将共刺激分子引入到肿瘤领域;他证明了转染B7配体的肿瘤细胞可以在小鼠体内诱导极强的免疫反应从而在局部和全身彻底清除肿瘤 (Cell,1992)。 这一工作建立了B7以及后续一系列共刺激分子途径在肿瘤免疫领域应用的理论基础,也对后续该领域的药物研发带来了很重要的提示。但是,B7/CD28&CTLA-4途径分子在体内大量表达,并不具有肿瘤特异的特点,并在免疫调节中起着广谱且不可或缺的控制作用。后续的抗CD28刺激性抗体(TGN1412),以及抗CTLA4抗体(ipilimumab)的临床试验也证明了很强的甚至是致命的免疫副作用。在一系列试验性工作的同时,陈教授更加坚定了集中精力寻找肿瘤相关的免疫逃逸分子的信念,最终发现了PD-L1/PD-1途径在肿瘤免疫领域的巨大应用。
以下是PD-1/PD-L1药物研发的一些关键节点:
1.1990年代初,陈列平提出肿瘤微环境存在特异性的免疫逃逸关键分子的假说。
2.1990~1991年,BMS 科学家Peter Linsley发现B7配体和CD28以及CTLA-4受体的相互作用。这一途径后来被普遍认为是T细胞从初始状态活化的关键途径。(PNAS, 1990; JEM,1991)
3.1992年陈列平第一次将B7共刺激分子引入到肿瘤领域,验证了共刺激分子在肿瘤免疫领域的巨大潜力,也更加坚定了他寻找肿瘤相关的免疫逃逸分子的信念。(Cell,1992)
4.1992年日本科学家Tasuku Honjo 从凋亡的B细胞系中克隆了PD-1,并一直认为这是一个参与B细胞调节,跟凋亡相关的分子。Honjo教授的研究兴趣一 直在于自身免疫领域,所以他在PD-1分子的工作,多年来一直局限在B细胞以及自身免疫方面。(EMBO J, 1992)
5.1997年,陈列平发现4-1BB抗体活化T细胞从而介导超强的抗肿瘤功能,使这一途径成为肿瘤免疫研究的热点。(Nature Medicine, 1997)
6.1997左右,时逢人类基因组计划的成功,陈列平研究组开始从人类基因EST(表达序列标签)库中寻找新的B7同源分子,从而开启了一系列免疫调节新分子的发现工作。
7.1999年,陈列平首次克隆并鉴定了人类B7-H1的T细胞调节功能(Nature Medicine, 1999) ,在后面的几年内,又陆续鉴定了B7-H2,B7-H3,B7-H4等免疫调节分子。
8. 1999年,Honjo教授发现PD-1敲除小鼠具有多器官的轻微自身免疫症状,这一工作清楚阐述了PD-1基因的免疫抑制功能,并揭示有可能参与自身免疫性疾病的发生发展。(Immunity, 1999)
9. 2000年,Gordon Freeman在陈列平发现B7-H1之后,证明了B7-H1/PD-1的相互作用,并将这一分子改名为PD-L1。(JEM, 2000)
10. 2002年,陈列平首次证明了B7-H1(PD-L1)途径作为肿瘤免疫逃逸的可能机制。B7-H1在多种人类肿瘤组织而非正常组织中高表达,并且其表达主要由干扰素来调节。重要的是,用抗体在体外或体内阻断该途径均可以恢复T细胞的免疫功能来攻击肿瘤。(Nature Medicine,2002)
11. 2004年,陈列平发现B7-H1(PD-L1) 敲除小鼠并没有明显的自身免疫表型,只是在肝脏有一定的免疫活化,这一工作进一步验证了B7-H1作为免疫负调分子的作用,并且验证了这一途径作为药物靶点的安全性。(Immunity,2004)
12. 2005年,陈列平发现抗体阻断B7-H1(PD-L1)或者PD-1途径均可以提高抗肿瘤免疫反应。(Cancer Research, 2005)
13. 2005年,Rafi Ahmed 通过LCMV慢性病毒感染模型验证了PD-L1/PD-1途径介导T细胞功能衰竭(exhaustion)的机制。不过这一慢性病毒感染模型和肿瘤有一定区别,所以这一发现在肿瘤领域的涵义此后争议不断。(Natue,2005)
14. 2006年,陈列平、Suzanne Topalian等开始在约翰霍普金斯大学医院倡导开展anti-PD-1抗体的首次临床试验。
15. 2012年,约翰霍普金斯大学医院,耶鲁大学纽黑文医院等研究机构开展anti-PD-1抗体首次临床试验结果发表。(NEJM,2012)
16. 陈列平研究组很早就开发出PD-L1的肿瘤染色方法,于2012年首次发表PD-L1肿瘤阳性率可以反映anti-PD1/PD-L1抗体临床效果的结果;并完善了PD-L1/PD-1途径的肿瘤免疫调节机制:介导肿瘤局部的获得性免疫逃逸 (adaptive resistance mechanism of immune escape in the tumor site)。(Science translational medicine, 2012)
17. 2013年,肿瘤免疫治疗被Science评为当年的科学突破之首。
18. 2014年,anti-PD-1抗体(Opdivo&Keytruda)得到FDA批准用于肿瘤临床治疗。
19. 2016年,anti-PD-L1抗体(Tecentriq) 得到FDA批准用于肿瘤临床治疗。
另外,抗人PD-1抗体的研发从2004年左右已经开始。当时设在新泽西的Medarex公司具备很好的人源抗体研发平台,最早合作开发了一系列免疫调节分子的人源化抗体,包括后来的nivolumab(anti-PD-1),ipilimulab(anti-CTLA4) 等等。Medarex于2009年被BMS收购。但是有趣的是,最开始BMS根本不看好nivolumab,而主要开发ipilimulab,所以nivolumab这个项目有点“半卖半送”的性质。正是因为这些原因,即使nivolumab在后来的临床试验中效果非常好,为了保证ipilimulab的开发和销售(2011年ipilimulab得到FDA批准),BMS并没有集中精力来开发nivolumab,导致了BMS在这一项目的优势逐渐降低;后来在某种程度上被Merck后来居上,这些战略上的失误是非常值得药物研发领域深思的。
PD-1药物的特点以及启示
在以上的时间节点中不难看出,从广谱调节初始T细胞的B7途径,到具有肿瘤微环境调节作用的PD-1/PD-L1途径,反映了免疫学家对T细胞不同状态的调控,以及对肿瘤微环境免疫调节的逐步深入理解,是免疫学和肿瘤学交叉研究产生的结果,也使得Immuno-oncology(免疫肿瘤学)这个领域逐渐发扬光大。有意思的是,PD-1抗体的抗肿瘤功能最初在很多动物肿瘤模型中,都不是太明显,甚至导致很多专家早期怀疑这一途径的重要性。而陈列平很早就发现,只有肿瘤微环境中存在免疫细胞特别是T细胞,而且同时具备PD-L1免疫逃逸这一机制的情况下,PD-1抗体才有着绝佳的效果,所以他坚信这一途径在人类肿瘤治疗中的应用,并全力推动这一途径的临床试验。在整个过程中,陈列平不管是在理论、基础研究、还是临床应用上都起着至关重要的作用。
PD-1/PD-L1这一途径的特殊之处在于:
1. PD-L1配体具有相当的肿瘤特异性,在肿瘤微环境中诱导表达,并且参与肿瘤微环境的免疫调节,在这一途径中起着最关键的作用;相反,PD-1的另一个配体PD-L2虽然亲和力PD-L1差不多,但其在肿瘤免疫中的作用要次要得多;
2. 这一途径是肿瘤影响免疫逃逸的关键机制;介导肿瘤引起的免疫缺陷;
3. 阻断PD-L1配体或者PD-1受体均可以修复进行中的,而不是重新产生肿瘤免疫反应。(JCI, 2015)
这些特点在目前已知的免疫调节分子途径中是非常独特的,严格来讲,有可能是当前肿瘤免疫领域唯一针对肿瘤免疫逃逸的关键分子机制。所以这一疗法可以针对多种肿瘤,获得很好的疗效,同时副作用较小。
但是PD-1抗体近年来被有意归类于针对免疫检查点抑制剂(checkpoint inhibitor)的药物,这是很不恰当的。免疫检查点这一概念非常模糊,不能清楚的概括PD-1药物的特点。而事实上,当前很多具有免疫抑制功能的分子都被笼统归为免疫检查点抑制剂,比如,IDO、IL-10、TGF-b以及近年来开始热起来的LAG3、TIM3、BTLA、VISTA等等。值得注意的是,PD-1/PD-L1药物的成功不代表任何具备免疫抑制作用的分子都有这样好的治疗作用;也不代表任何和免疫相关的治疗手段都应该得到热炒或者开发。后续的很多肿瘤免疫靶点如LAG3、TIM3、VISTA、TIGIT等,以及CAR-T、Cancer Vaccine等免疫治疗方法,在特异性、有效性、安全性上都有待考证。因此,在没有客观冷静的分析和决策下,疯狂炒作肿瘤免疫领域的做法是不恰当的,不仅会影响该领域的发展,甚至将导致更大更多的泡沫。
肿瘤免疫领域需要更多类似PD-1/PD-L1途径的具有肿瘤微环境免疫调节功能的全新靶点出现,特别是基于新的肿瘤免疫逃逸机制。这种详细探索肿瘤微环境免疫逃逸新机制并且进行有效干预的策略,或者借助蛋白工程的手段来使得一些免疫调节药物来增加肿瘤特异性将是以后的趋势。这也是陈列平实验室从10多年前就开始构建一系列新分子发现平台、也更加集中精力发现新的肿瘤微坏境免疫调节分子的初衷。为此,在可以预见的将来,我们期待肿瘤免疫领域能够有更多更好的肿瘤免疫调节分子得到发现,并且可以有效地解释肿瘤的免疫逃逸机制,从而为肿瘤治疗带来新的革命性突破,最终达到把癌症变成慢性病甚至彻底治愈癌症的目标。
本文原载微信公号《华人抗体》,《知识分子》获授权刊载。作者感谢王守业博士以及耶鲁大学免疫系Jingwei Sun的仔细阅读和修正。
本文仅供医学药学专业人士阅读

























 X
X