肿瘤免疫治疗最耀眼的三大明星药物PD-1抗体Opdivo(O药)、PD-1抗体Keytruda(K药)、PD-L1抗体Tecentriq(T药)均已被FDA批准用于多种肿瘤的二线治疗,包括恶性黑色素瘤、非小肺癌、肾癌、霍奇金淋巴瘤、膀胱癌和头颈癌。
凭借一个神奇的三期临床试验KEYNOTE-024,Keytruda改写了历史,成功冲击非小细胞肺癌的一线用药:对于PD-L1表达超过50%的非小细胞肺癌,K药单独使用,优于传统的化疗,有效率更高(44.8% VS 27.8%)、副作用更小(26.6% VS 53.3%)。Opdivo也尝试冲击一线用药,不过,失败了。
这次轮到了PD-L1抗体Tecentriq。
1月9日,罗氏宣布:我们已经向FDA提交了Tecentriq用于晚期膀胱癌患者的新适应症申请,包括Tecentriq一线用于不适合顺铂化疗的晚期患者和术前或术后接受化疗至少12个月后疾病进展的晚期患者,FDA已经接受了这个申请,并且最迟会在是今年4月30日决定是否批准。
罗氏的这个新适应症申请是基于II期临床试验IMvigor210,这个临床试验招募了两组患者,第一组招募了119名不适合顺铂化疗的晚期初治患者,使用PD-L1抗体Tecentriq进行一线治疗,剂量是1200mg,三周打一次。经过平均17.2个月的随访,有效率是23%,包括9%的患者治疗完全消失,中位生存期是15.2个月。就是基于这个数据,FAD在考虑是否批准Tecentriq一线用于晚期膀胱癌。
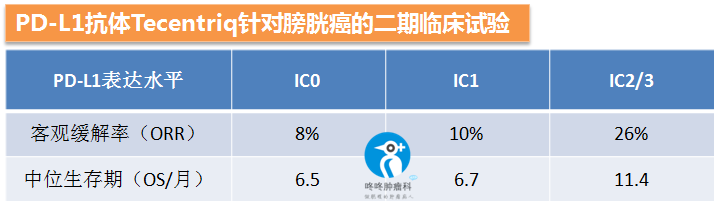
第二组招募了316名铂类化疗失败的患者,使用PD-L1抗体Tecentriq进行二线治疗,由于数据非常漂亮,FDA已经批准了改适应症,具体临床数据如下:PD-L1阴性的(IC0)的患者的客观缓解率是8%,中位生存期是6.5个月;而PD-L1中高表达的患者(IC2/3)分别是26%和11.4。
目前,PD-L1抗体Tecentriq已经在多种肿瘤中有很好的临床数据,具体详情可点击查看罗氏重磅抗癌药Tecentriq临床数据全解析,期待2017年肿瘤免疫治疗药物带来更多的惊喜。
参考文献:
1. Rosenberg, J.E., et al., Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet, 2016. 387(10031): p. 1909-20
2. http://www.onclive.com/web-exclusives/fda-grants-atezolizumab-priority-review-for-second-bladder-cancer-indication
本文仅供医学药学专业人士阅读







.jpg-pd13)


















 X
X