星爷的电影《功夫》告诉我们,不要小看你身边那些其貌不扬的人,因为里面可能隐藏着绝世高手。
这不,最近哈佛大学的科学家就发现,一款被世人用了60年的广谱抗癌老药——环磷酰胺,竟然身怀免疫治疗绝技!
高剂量的环磷酰胺不仅能直接杀死癌细胞,还能将巨噬细胞引到骨髓,并激活巨噬细胞的“胃口”,大口大口地吃掉癌细胞,对于治疗淋巴瘤有奇效。并且,高剂量环磷酰胺还可以解除目前一线治疗药物遇到的抗性,大幅增强其治疗效果。
目前研究者们已经开展了相关的临床试验,相信在不久的将来我们就能看到其临床效果。相关发表在著名学术期刊《癌症发现》,论文的第一作者是Chen Lossos博士,通讯作者是David M. Weinstock教授[1]。

Weinstock教授(来自哈佛大学)
1954年,环磷酰胺首次被FDA批准作为一种标准的抗癌药[2]。
1959年,英国医生Denis Parsons Burkitt和他的同事,首次将环磷酰胺用于治疗一种死亡率100%的儿童淋巴瘤——伯基特(Burkitt)淋巴瘤,取得了惊人的效果。并且有时候,仅需单独使用高剂量的环磷酰胺,就能将这种侵袭性的癌症治愈[3]。
环磷酰胺治疗癌症的原理一般被认为是其烷基化作用,它能将烷基基团转移到癌症细胞的DNA上,导致DNA断裂,抑制DNA的合成,并诱导细胞凋亡 。
在随后的发展中,低剂量的环磷酰胺以及其他的烷基化试剂,逐渐被用于治疗多种癌症,包括乳腺癌、卵巢癌和儿科癌症等等,因此,环磷酰胺也被称为第一种广谱抗癌药[2]。
 Burkitt淋巴瘤(来自wikimedia)
Burkitt淋巴瘤(来自wikimedia)
不过,在后面的研究中,人们却渐渐发现环磷酰胺的效果过于好了,超出了烷基化试剂应有的能力[4]。
比如,高剂量的环磷酰胺能直接清除骨髓中的淋巴瘤。
此外,利妥昔单抗和阿伦单抗两种治疗淋巴瘤的一线治疗药物,虽然能清除血液和脾脏中的淋巴瘤细胞,但是在骨髓中却遇到了强烈的耐药性,而高剂量的环磷酰胺,能解除这种耐药性[5]。
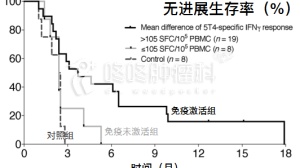
Weinstock教授团队的研究人员就发现,与阿霉素这种同样是引起DNA断裂,引发细胞凋亡的抗癌药相比,单独使用高剂量的环磷酰胺,能将小鼠骨髓中的淋巴瘤细胞降为阿霉素的1/10。
而且,与阿霉素与阿伦单抗联用相比,环磷酰胺与阿伦单抗联用的效果强88-160倍,并大幅提高肿瘤小鼠的存活率。
 环磷酰胺(CTX)治疗淋巴瘤
环磷酰胺(CTX)治疗淋巴瘤
在人们之前的认知中,环磷酰胺和阿霉素一样,都是用过引发DNA断裂,诱导细胞死亡的。不过,现在发现环磷酰胺的效果这么强,可能不仅仅是DNA断裂这么简单了。
环磷酰胺的强大效果到底来自哪里?
其实之前人们还观察到,虽然环磷酰胺具有极强的淋巴消除作用,但是却唯独对巨噬细胞没有抑制效果,反而会增加巨噬细胞的癌细胞清除能力[6]。
因此,环磷酰胺杀癌细胞以及增强单抗效果的作用,可能都是通过巨噬细胞来完成的。
研究人员在小鼠进行实验发现,原来环磷酰胺能吸引巨噬细胞向骨髓移动,增加骨髓中巨噬细胞的数量。
更重要的是,环磷酰胺能改变巨噬细胞的促吞噬因子和抗吞噬因子,大幅增强其吞噬能力,让巨噬细胞大口大口的“啃”癌细胞。
 巨噬细胞的吞噬作用
巨噬细胞的吞噬作用
图片来自clincancerres.aacrjournals.org
因为利妥昔单抗和阿伦单抗的抗癌作用之一,也是通过增强巨噬细胞的吞噬能力进行的。因此,环磷酰胺对巨噬细胞的招募和激活,也对这两种单抗起到了明显的增幅作用。
随后,研究人员还通过单细胞测序发现,环磷酰胺能增加骨髓中多种细胞因子,如VEGF和IL-16等的表达,特异性地招募巨噬细胞。此外,环磷酰胺还会激活多种基因,增强巨噬细胞的吞噬能力。
现在,真相大白了,原来人们用了60年的抗癌药,竟然还是一个免疫治疗药,难怪效果非凡!
为了验证环磷酰胺在人体中的效果,研究人员已经发起了一个用环磷酰胺加阿伦单抗,治疗CD-52阳性淋巴瘤患者的临床试验(NCT03132584)。
相信我们很快就能见到它的真实实力了。
参考资料:
[1] Lossos C, Liu Y, Kolb K E, et al. Mechanisms of lymphoma clearance induced by high-dose alkylating agents[J]. Cancer Discovery, 2019.
[2] https://www.sciencedaily.com/releases/2019/07/190701144521.htm
[3] Clifford P, Singh S, Stjernswärd J, et al. Long-term survival of patients with Burkitt’s lymphoma: an assessment of treatment and other factors which may relate to survival[J]. Cancer research, 1967, 27(12): 2578-2615.
[4] Yang W, Soares J, Greninger P, et al. Genomics of Drug Sensitivity in Cancer (GDSC): a resource for therapeutic biomarker discovery in cancer cells[J]. Nucleic acids research, 2012, 41(D1): D955-D961.
[5] Pallasch C P, Leskov I, Braun C J, et al. Sensitizing protective tumor microenvironments to antibody-mediated therapy[J]. Cell, 2014, 156(3): 590-602.
[6] Wang Y J, Fletcher R, Yu J, et al. Immunogenic effects of chemotherapy-induced tumor cell death[J]. Genes & diseases, 2018, 5(3): 194-203
本文仅供医学药学专业人士阅读






















 X
X