嘉和生物药业有限公司(以下简称“嘉和生物”)自主创新研发的抗PD-1单抗产品“杰诺单抗注射液”向上海市食品药品监督管理局提出临床研究注册申请,并于近日获得了上海市食品药品监督管理局出具的《药品注册申请受理通知书》。
产品名称:杰诺单抗注射液
剂型:注射剂
规格:7ml:70mg
申请事项:新药申请
申报阶段:临床。
注册分类:治疗用生物制品1类
申请人:嘉和生物药业有限公司
受理号:CXSL1600016沪
 嘉和生物CEO
嘉和生物CEO
“杰诺单抗注射液”为嘉和生物在中国申报临床研究的第2个治疗用生物制品1类新药(之前嘉和已经有6个单抗产品申报临床研究,包括1个治疗用生物制品1类和5个治疗用生物制品2类产品)。杰诺单抗是具有全新序列的创新抗PD-1单抗,嘉和生物拥有核心自主知识产权,其主要的潜在适应症包括各种血癌及黑色素瘤、非小细胞肺癌、肾癌等多种实体瘤。
杰诺单抗的作用靶点PD-1(细胞程序性死亡受体-1)是一大类被称为Immmune Check-Point(免疫检查点)蛋白中的最典型代表,PD-1在T淋巴细胞上过度表达将抑制T淋巴细胞对肿瘤细胞的杀伤作用,是肿瘤细胞免疫逃逸的主要原因之一。以靶向PD-1及其配体PD-L1的单抗药物为代表的肿瘤免疫检查点疗法被视为未来最有前途的肿瘤治疗方法之一,曾被美国《Science》杂志评为2013年全球十大科学突破性技术的榜首。它可以有效地克服现有肿瘤靶向治疗药物(包括靶向类单抗)的耐药性问题。同时,肿瘤免疫疗法未来最大的潜力将来自于与其他肿瘤疗法的组合使用,包括与放疗、化疗、靶向治疗药物和单抗、治疗性疫苗的组合使用。
目前在国际上已经上市的PD-1/PD-L1单抗药物有默沙东公司的Keytruda®(通用名:pembrolizumab)和百时美施贵宝公司的Opdivo®(通用名:nivolumab),根据两家公司2015年年报,这两个产品在2015年已经分别实现5.66亿美元和9.42亿美元的年销售额。国际上主要的已上市和晚期研究的PD-1/PD-L1单抗药物产品情况如表一所示(其中销售预测来自于Evaluate Pharma等行业市场分析公司)。另根据研究机构Global Business Insight预计,PD-1抑制剂在全球最终会造就一个300-350亿美元的巨大市场。
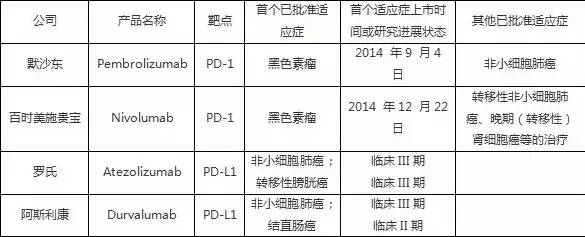 表一
表一
根据CFDA及药品审评中心网站查询的信息,目前国内尚无抗PD-1/PD-L1单抗药物获批生产。在临床试验和临床申报方面,百时美施贵宝已提交了2项Nivolumab注射液的进口临床申请(其中一项已获临床批件并正在开展临床试验),默沙东提交了5项Pembrolizumab注射液的进口临床申请,目前均处于在审评状态。国内也有多家企业在研发抗PD-1/PD-L1单抗产品,除嘉和生物外,恒瑞医药与泰州君实生物科技有限公司2家企业各自研发的产品已获得临床试验批件,百济神州生物科技有限公司的产品申请临床。有关PD-1/PD-L1单抗药物的国内企业申报情况如表二所示。
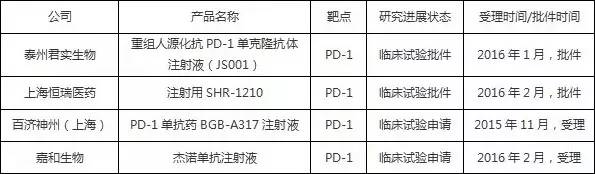
表二
杰诺单抗注射液临床研究申请获得受理,进一步表明嘉和生物单抗药物研发创新能力居于国内领先和国际先进水平。嘉和生物拥有成熟的单抗工艺质量技术平台,且拥有丰富的产品组合,未来抗PD-1单抗产品可以与公司其他靶向单抗产品进行组合用药,形成强大的协同效应;另外,嘉和生物在产品研发过程中积极采用先进的工艺技术,可实现较高的单位表达量(其第一个单抗产品(GB221)的表达量可达到10g/L以上),其所研发的产品未来将具有显著的成本竞争优势。
根据国家药品注册相关法规,该产品临床研究申请获得受理后,将由国家食品药品监督管理总局药品审评中心进行技术审评,同时中国食品药品检定研究院将对申报样品进行质量检定和质量标准复核,在通过国家食品药品监督管理总局的审评和审批并获得临床试验批件后方能开展临床研究工作,期间检验、审评和审批的结果以及时间都具有一定的不确定性。
(来源:单抗BD)
本文仅供医学药学专业人士阅读






















 X
X