
周一早上打开微信,忽然看到未读消息:两位及其聪明、以自身体会建立了癌症治疗手札的病友领袖请我帮忙查找关于移植患者使用免疫检查点(checkpoint)抑制剂药物的资料,心生敬佩。
之所以动笔写这篇文章,是因为它让我看到病友们难以想象的乐观、积极和专注的光辉。同时也是提醒大家被掩盖在愈卷愈盛的免疫检查点(checkpoint)抑制剂风暴下隐藏的巨大风险:移植患者的使用。
为什么要这样说?难道是因为被两位领袖大人拜托了吗?
并不是,菠菜作为一个主页君的情怀让我试图解释清楚这些药物的机制。咚咚的每一位病友都有权力知道我用的药物到底在我的身体里起了什么作用。以及到底会有什么危害,这些危害是怎么产生的。
菠菜提到的移植主要是指器官移植。即肝移植、肾移植或其他一些少见的心脏移植等(当然也许还有孤陋寡闻的菠菜没有听说过的移植)。这些器官的移植都是建立在一个复杂的免疫指标——HLA表达上决定的。通俗的说,HLA分子配型成功才能顺利完成移植。
由于人体免疫系统的存在,移植结束后也并不是高枕无忧的。移植患者们还要根据指标长期服用免疫抑制剂来对抗人体的排斥。人体对移植器官的排斥这一点恰恰也是PD1对移植患者双刃剑刃锋所在。

回到PD1,虽然PD1对肝癌的大临床数据并没有详细披露,但就目前而言,根据使用PD1的咚友反馈,PD1对部分肝癌患者会有及其特别的效果。我们会陆续整理于公众号发布。
而关于肾癌的PD1相关治疗数据就在前不久刚刚公布了,给各位肾癌病友准备了一个大大的新年礼物:PD1对肾癌的应答率仅次于恶性黑色素瘤,达到了30%左右的客观缓解率(即病灶持续缓解维持一段时间)。明星病例我们也会在后续的报道中整理。
面对这么大的疗效蛋糕,移植患者们不可能不注意到。但遗憾的是,在PD1的适应症中,移植患者是被明确排除在外的。
就在PD1上市初期,也有几位移植患者对PD1进行过尝试,但无一例外都产生了不太好的结果。为帮助移植患者做出治疗抉择,菠菜整理了国外发表的几位移植患者使用免疫检查点抑制剂的案例。由于移植患者被排除在PD1的适应症之外,因此目前仅有移植患者使用CTLA-4抑制剂——Yervoy的案例。
菠菜在文章的题目中也提到了它是一把双刃剑。因此我们也提醒更多的移植患者,对免疫检查点抑制剂的使用一定要万分谨慎:不管是医生还是病人,必须遵循“无害为先”的游戏规则。
案例一:肝移植患者使用CTLA-4抗体Yervoy治疗恶性黑色素瘤
患者情况:男性,67岁。2006年首次确诊肝癌并伴HCV感染。同年进行肝移植手术。肝脏的供体是一位49岁的男性,没有肿瘤史。
移植之后患者使用他克莫司(tacrolimus)和霉酚酸酯(mycophenolate mofetil)防止排斥,肝功能一直正常。肝移植后分别在2008年和2010年进行过两次活检,均显示HCV复发,但在这期间转氨酶一直正常[1]。
2009年9月,发现皮肤溃烂并活检确诊黑色素瘤;随后进行手术扩大切除病灶,术后淋巴组织活检确定这是局部的病灶,并没有侵犯淋巴和神经。
2010年,影像检查发现右肾一个5cm的弥散病灶,手术切除后组织学检查确诊肝癌转移灶。随后免疫抑制剂改为每天3mg 雷帕霉素和每天两次各500mg的霉酚酸酯。
2013年10月,患者发现左腮腺出现肿块,后活检证实是黑色素瘤,基因情况BRAF不突变,cKIT不突变。11月进行Pet-CT发现双肺、多处骨头和腮腺多发转移。脑部核磁未发现脑转移。
2014年1月,检查发现结节增多,骨转病灶增多,肝上也出现病灶。这时候患者把雷帕霉素的剂量从3降到1mg每天,停止了霉酚酸酯(这时候有个报道说停了抑制剂可能肿瘤会缩小)。随后进行了5个疗程的化疗和多种放疗,最后依然进展:肝脏,肺部,脾脏和总格淋巴结几乎沦陷。(不得不佩服患者的大心脏,三个月时间仅仅做了检查未治疗,菠菜长跪不起。)
2014年4月,经专家讨论,决定采用CTLA-4抗体Yervoy治疗。在4月到7月,进行了四次3mg/kg的Yervoy治疗,同时雷帕霉素保持在1mg每天。为了防止排斥,每周检测肝功。患者几乎没有经历严重的副作用,ALT/AST和碱性磷酸酶在用药期间基本稳定,停药之后有一段时间上升,具体ALT和AST的数据如下图,最高到了三级副作用,但是患者没人什么体感,所以暂时没用激素处理。到了第20周的时候,所有的指标都恢复到一级副作用。在整个治疗期间,总胆红素正常。在使用Yervoy的十个月的时候,没用经历太多的治疗,各种指标都是比正常值高一点。

患者使用Yervoy之后的ALT/AST变化
2014年7月,进行CT发现患者的肺部和肝部肿瘤有缩小很多,具体如下图。
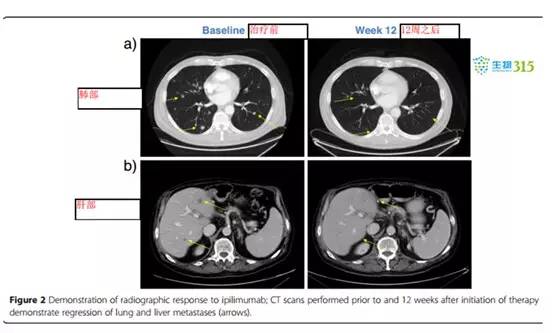
患者使用12周之后的影像变化
案例二:肾移植患者使用CTLA-4抗体Yervoy治疗恶性黑色素瘤
患者情况:2000年10月肾移植,有高胆固醇的病史。移植后使用强的松和他克莫司防止排斥,肾功能保持正常,血液指标肌酸酐1.2mg/dL。[2]
2008年,发现左胸有一个8mm的黑色素瘤,且淋巴结转移,原发灶手术扩切并进行了淋巴结清扫术。后来出现了两个转移灶,进行了手术和局部放疗。
2011年1月,PET-CT确诊左胸壁和肝脏新发转移,后采用替莫唑胺联合铂类化疗的方案治疗,结果无效进展。
2011年8月,会诊决定采用CTLA-4抗体Yervoy治疗。在进行Yervoy治疗之前,就暂停了他克莫司,每天服用5mg的甲强龙防止排斥,持续六周,做完预处理后开始使用Yervoy。治疗期间肾功能保持正常。
2011年11月,进行PET-CT检查,左胸壁和肝脏的病灶减小,同时移植肾的FDG摄取值正常。
2012年4月和9月已经2013年1月,PET-CT复查显示病灶持续缩小,临床结果PR。
案例三:肾移植患者使用CTLA-4抗体Yervoy治疗恶性黑色素瘤
患者情况:58岁,男,多囊性肾病导致肾衰竭,2004年接受肾移植。移植后使用强的松、他克莫司和霉酚酸酯防止排斥,肾功能正常。
2011年,前额发现一个4.2mm的黑色素瘤病灶,BRAF和C-KIT无突变。确诊后进行了手术切除,术中发现四个淋巴结转移。考虑到免疫抑制剂会促进肿瘤的生长,停止他克莫司和霉酚酸酯,每天5mg的强的松防止排斥。
2012年1月,PET-CT确诊肺部转移和肠系膜淋巴结转移。后患者使用替莫唑胺系统治疗。但是没有效果,病情进展,并且发生骨转移。
2012年5月,开始CTLA-4抗体Yervoy治疗,同时每天5mg的强的松防止排斥。在整个Yervoy治疗过程中,患者的肾功能保持正常。副作用主要是2级的肠炎,采用激素解决。使用Yervoy四次后,PET-CT显示多处位置肿瘤缩小。7周后再次PET-CT检查发现病情进展。考虑到已发生过肠炎副作用,患者没有继续进行Yervoy治疗。
移植患者的探索
由于国内患者相比国外患者而言,在PD1抑制剂的使用方面有严重的信息不对称问题,虽然在使用前也进行了充分的讨论(包括默克的研发人员也有参与),但仍然没有预料到PD1会对移植患者造成严重后果。目前据菠菜统计,至少有四例国内移植患者使用过PD-1抑制剂对抗肿瘤,其中2人明确发生急性排斥反应,经过复杂的激素和手术治疗才成功控制排斥,并付出了肿瘤进展的代价。其余1人使用PD1时病情太重,PD1并没有力挽狂澜;1人使用PD1 2次后肝功异常,激素处理后恢复,无法确定是否排斥。
虽然国外有移植患者使用CTLA-4抑制剂Yervoy治疗黑色素瘤的先例,但这不代表所有免疫检查点抑制剂都适用于移植患者,从目前来看,PD1抑制剂就有可能对移植患者造成严重后果。所以请移植患者对于免疫制剂一定谨慎。通过免疫治疗攻击癌细胞前就可能对移植器官造成严重的伤害。通过Yervoy的几个例子,我们发现似乎同时使用抗排斥的药物,可以达到Yervoy控制肿瘤却不引起器官排斥排斥的效果。但这仅仅还是一个猜想,还有待接下来的临床试验证实。
此外,总结国外几位患者的特点,共同点都是有很长的移植史(分别是8年、11年和8年)。经过长时间的相处,宿主的免疫系统可能已经耐受。所以,器官移植时间短的患者使用免疫检查点抑制剂更有风险。
参考文献: [1]Morales, R.E., et al., Safety and efficacy of ipilimumab to treat advanced melanoma in the setting of liver transplantation. J Immunother Cancer, 2015.3:p. 22. [2]Lipson, E.J., et al., Successful administration of ipilimumab to two kidney transplantation patients with metastatic melanoma. J Clin Oncol, 2014.32(19): p. e69-71.
本文仅供医学药学专业人士阅读




















 X
X