
癌症之所以难以治疗根本原因在于它一直在“动”,癌症总是随机地再产生基因突变,以更好地适应药物和免疫系统的选择压。
癌症的“动”不只是体现在癌症细胞基因突变的变化上。还体现在病理分型上,也许原来是肺腺癌,在治疗的过程中逐渐地变为了肺鳞状细胞癌、小细胞肺癌等,这些都增加了癌症这一疾病的治疗难度。
癌度今天给大家分析一篇文献报道的案例,一个非小细胞肺癌患者如何在化疗和PD-1药物联合治疗的过程中,从肺腺癌转移成为了肺鳞癌。这里究竟发生了什么?以及如何确定这一转化过程的。
2012年4月,一名69岁从未吸烟的男性出现干咳的症状。胸部CT扫描发现右肺上叶有一个7.2厘米大小的占位病灶,双侧纵膈和锁骨淋巴结肿大。病理活检发现是肺腺癌,但是没有EGFR和ALK基因突变,患者经过了姑息性放射治疗,6个周期的培美曲塞联合铂类的化疗,治疗后发现患者的肺部肿瘤病灶缩小。自此以后患者失去了随访。
2015年6月,这名患者突然又出现了,主诉左肩膀和手臂肿胀,胸部CT检查结果显示右肺上叶肿瘤有2.5厘米大小的病灶,左侧胸壁和腋窝淋巴结有新的转移性病灶,左侧胸腔积液。左侧胸壁肿瘤的活检显示腺癌但是伴有肉瘤样改变(甲状腺转录因子、细胞角蛋白和波形蛋白都是染色阳性)。患者接受了单一的化疗,使用的药物是多西紫杉醇和口服的长春瑞滨,对于胸壁的肿瘤则使用的是放射治疗,计量为3000cGy。
2015年10月起,患者每隔3周接受一次派姆单抗的治疗,计量为2mg/kg,胸壁肿瘤和左侧腋窝淋巴结变小。随后出现的大量的胸腔积液在口服类固醇治疗后也逐渐减少。患者在四个疗程后,要求停掉了PD-1药物派姆单抗。患者对派姆单抗治疗应答表现为局部应答,持续时间达6个月。
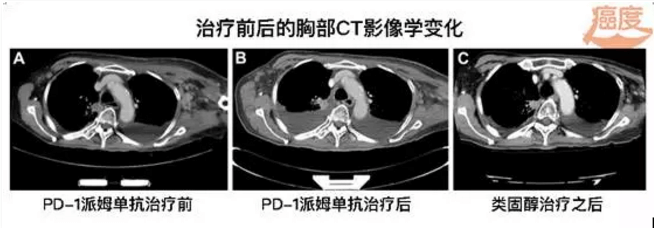
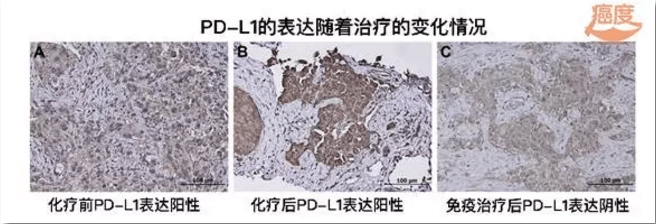
派姆单抗和化疗治疗6个月之后,患者左胸壁发现一个皮下结节,切除活检发现为鳞状细胞癌伴有肉瘤样改变(免疫组化显示CK7、P40和Vimentin阳性)。其中PD-L1在三个不同时期的样本中,都是PD-L1阳性。到2016年1月,患者一直处于观察阶段,没有经过任何的治疗。
2016年10月,患者注意到左侧腋窝区域存在新的淋巴结,进行穿刺病理诊断发现,CK7和P40为阳性,不过这一次PD-L1是阴性。手术之后的2个月,患者再次观察到左侧腋窝区域有复发的小结节。
2016年12月,患者拒绝进行组织活检,重新开始使用PD-1派姆单抗治疗。
我们知道即便是EGFR阳性的肺腺癌患者,绝大多数都不可避免地面对耐药的问题。
组织表型转化是其中一个机制。肺腺癌转化为小细胞肺癌是其中一种耐药的机制,已有的报道中非小细胞肺腺癌向小细胞肺癌的组织表型转化导致的耐药概率占到14%。
肺腺癌向肺鳞癌的组织表型转化也是耐药机制的一种,但是多数组织表型转化的报道是在靶向药物治疗的过程中发生的。是否在化疗或免疫治疗的过程中,这种组织表型转化也会发生?
癌度今天给大家的案例就描述了这种情况,化疗和PD-1治疗也会导致非小细胞肺腺癌的组织表型转化。
不过这个案例有个特点,癌度带大家一起结合EGFR靶点药物治疗下的组织表型转化来分析一下。
在EGFR靶点药物的治疗下发生的组织表型转化,肺腺癌转化为了肺鳞癌,但是最开始的驱动性基因突变如EGFR还是存在的。部分时候使用靶向药物还管用。
对于化疗和免疫治疗下发生的组织表型转化,在本案例中,化疗和免疫治疗下最开始发生组织表型转化时PD-L1表达,但是随着后面免疫治疗中断,PD-L1逐渐地检测不到了。
目前PD-1的价格也一直有所变动,建议在网站首页查看参考价。
我们从这个文献的最后知道患者在2016年12月重新使用了PD-1派姆单抗治疗,但是PD-L1表达下降究竟是否会影响其疗效并没有报道。不过我们从中可以看出在靶向药物治疗下的组织表型转化,与化疗和PD-1治疗下的组织表型转化,二者的机制可能对后续的治疗是有区别的,这更需要临床专家做全面汇总和分析,综合评估潜在收益、风险、经济花费等多种因素。
组织表型转化里面的机制很复杂,尽管患者第一次活检是纯的肺腺癌,但是不排除最开始就是腺癌鳞癌混合型,另外的可能性是癌症干细胞在治疗措施的选择压下的分化。
但总之我们通过这个案例可以看出。不管是靶向治疗、化疗、PD-1等免疫药物治疗,必要时对新发的耐药病灶进行再次活检,检测新的基因突变,是否有组织表型转化,这样对于后续的精准用药都是非常重要的。
本文仅供医学药学专业人士阅读




.jpg-pd13)





















 X
X