2016年10月24日,FDA加速批准K药用于PD-L1阳性肺癌患者的一线治疗。
2017年1月11日,FDA受理K药联合化疗用于非鳞非小肺癌患者的一线治疗。
昨天,FDA加速批准默沙东的PD-1抗体Keytruda联合化疗用于非鳞非小细胞肺癌的一线治疗,而且不受PD-L1表达的限制,全线通吃。
这意味着:
新诊断的部分肺癌患者,可以直接使用这种最顶级配置的免疫+化疗的豪华套餐。
FDA是基于一个名为Keynote-021的临床试验批准的这个组合用药方案。
临床设计
招募123位晚期初诊的肺癌患者,绝大部分都是肺腺癌患者,60位患者接受Keytruda联合培美曲塞和卡铂,63位患者接单纯的双药化疗。
临床数据
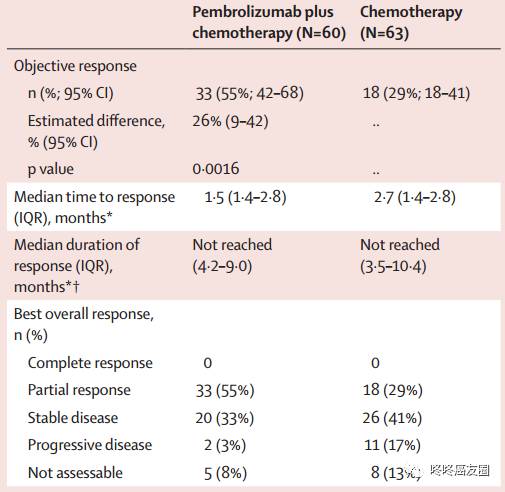
副作用
PD-1联合化疗的常见副作用包括乏力、恶心、便秘、皮疹食欲减退等,跟单药化疗比,联合用药组3-4级严重副作用发生的比例略高。

这项研究的进一步的随访结果会在接下来的ASCO年会中报道,到时候我们也会继续跟踪,尤其是生存期的数据。
参考文献:
[1]http://www.onclive.com/web-exclusives/fda-approves-frontline-pembrolizumab-combo-for-nsclc
[2]Langer CJ et al.Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study.Lancet Oncol. (2016)

本文仅供医学药学专业人士阅读























 X
X