作者:老马 来源:希望树
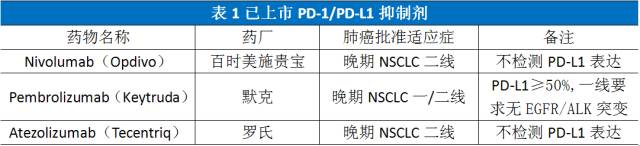
PD-1蛋白与其配体PD-L1的结合下调T细胞的活性,会阻断体内免疫系统对肿瘤细胞的攻击。PD-1/PD-L1抑制剂可以阻断PD-1与PD-L1的结合,阻断负向调控信号,使T细胞恢复活性,从而增强免疫应答。美国FDA已批准治疗肺癌的PD-1/PD-L1抑制剂见表1。
一、治疗方案
1、一线治疗
KEYNOTE-024是一项随机对照III期临床研究,305例PD-L1阳性晚期NSCLC患者随机分配接受Keytruda(200mg/每3周)或含铂化疗(紫杉醇+卡铂,培美曲塞+卡铂,培美曲塞+顺铂,吉西他滨+卡铂,吉西他滨+顺铂)一线治疗,非鳞肺癌患者允许接受培美曲塞维持治疗。此外,随机分配至对照组的患者在疾病进展时可选择转向Keytruda治疗。临床结果见表2。
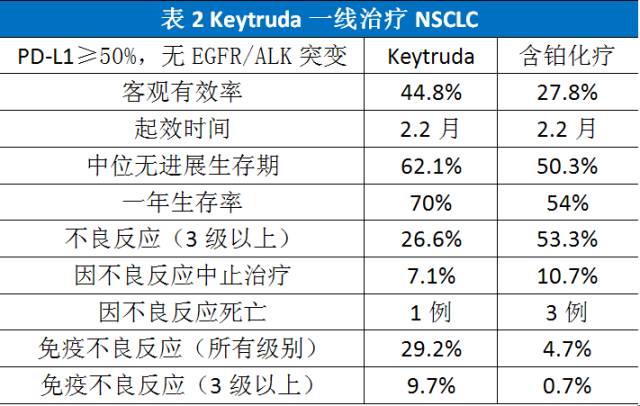
Keytruda组(n=154)的主要不良反应为腹泻14.3%、乏力10.4%和发热10.4%,主要的3级以上免疫不良反应为严重皮肤毒性3.9%、肺炎2.6%和结肠炎1.3%,没有发生5级免疫不良反应。
化疗组(n=151)的主要不良反应为贫血44.0%、恶心43.3%和乏力28.7%。主要的3级以上不良反应为骨髓毒性、乏力和缺乏食欲。
亚组分析结果显示Keytruda组的优势人群为男性、吸烟或鳞癌患者。
入组者占筛选患者30.2%,这部分PD-L1 表达水平≥50%且无EGFR/ALK突变的NSCLC一线治疗选择Keytruda比传统含铂双药化疗有更高的有效率,更长的生存期和更小的副作用。
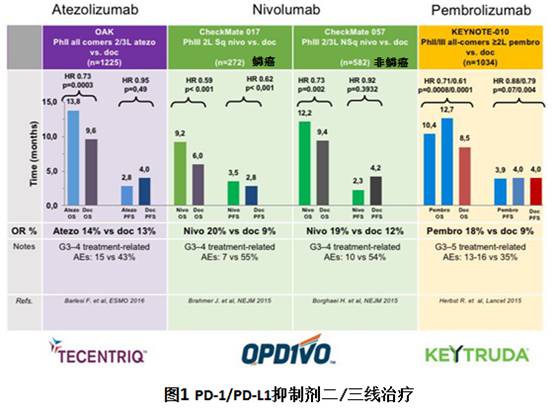
2、二线以上治疗
二、PD-L1检测
1、检测方法
PD-L1的检测是基于细胞蛋白水平的检测,在手术、气管镜或穿刺后取得的肿瘤组织进行切片染色后使用免疫组化方法。目前已上市的三种PD-1/PD-L1抑制剂有各自的伴随诊断测试,见表3。

2、PD-L1表达水平与疗效
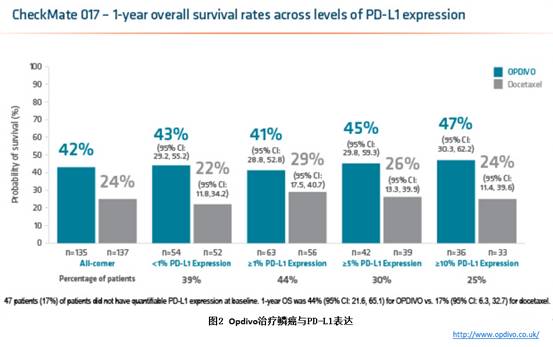
CheckMate057研究显示,Opdivo对于PD-L1表达阳性的晚期非鳞癌,相对多西他塞有临床获益。CheckMate017研究显示,Opdivo对于晚期鳞癌,不论PD-L1的表达情况,相对多西他塞有临床获益,见图2。
OAK研究显示,Tecentriq在随机化分组(ITT)完成后的人群中,不论PD-L1的表达情况,对所有组织亚型都具有临床获益,见图3。

KeyNote 001和KeyNote 010研究显示,Keytruda对于PD-L1表达强阳性的晚期NSCLC,无论组织学类型,有显著临床获益,见图4和图5。Keytruda对于晚期鳞癌,不论PD-L1的表达情况,相对多西他塞有临床获益。
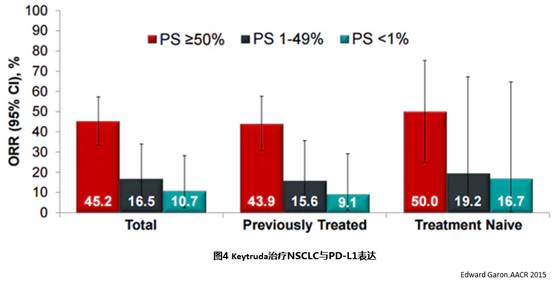
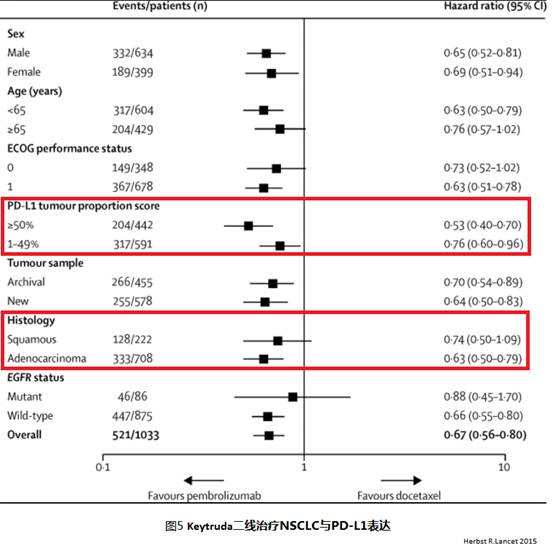
三、患者情况
1、吸烟患者
OAK研究显示,吸烟患者的PD-L1表达水平略高于非吸烟患者,Tecentriq治疗吸烟患者的客观有效率和无进展生存期显著优于非吸烟患者,但非吸烟患者仍有总生存获益,两治疗组的中位OS分别为16.3 vs 12.6个月,见图6。
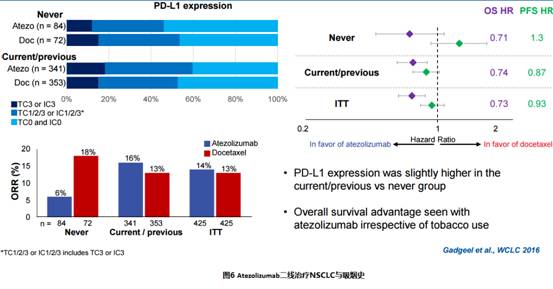
2、脑转移患者
基线存在脑转移的患者中,Tecentriq对比多西他赛的OS获益明显,分别为20.1 vs 11.9个月,见图7。
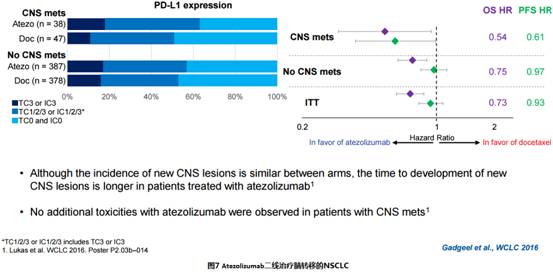
Opdivo二线治疗5名晚期NSCLC患者,2名男性,4名有吸烟史,PS0-2,3名腺癌,1名鳞癌,1名病理不确定,全部EGFR和ALK阴性,2名KRAS突变。5名患者均有脑实质转移,其中2名有脑膜转移,无症状,都未经激素或局部治疗。1名完全缓解,1名脑膜转移部分缓解,起效时间为5周和9周,无进展时间为24周+和28周+。1名脑膜转移稳定10周。躯体疗效与脑部疗效高度一致。
Opdivo在意大利的记名供药计划中,一共有372例肺鳞癌患者,其中38例(10.2%)有无症状的脑转移。Opdivo每二周一次,每次3mg/kg,疗程最长2年。Opdivo中位给药次数6次(范围1-18次)。1例完全缓解,6例部分缓解,11例稳定。客观有效率26%,疾病控制率47%,中位无进展生存期5.5月,中位总生存期6.5月。1例患者因副作用终止治疗,21例因其它原因终止治疗。
Keytruda二线治疗18名晚期NSCLC患者,PD-L1阳性,均有脑转移(直径5mm-20mm,无症状,未经激素或局部治疗)。6名脑转移部分缓解,客观有效率33%,另外有9名患者死亡,中位生存时间为7.7个月。
Rathi Narayana Pillai回顾分析了31名晚期NSCLC患者使用PD-1/PD-L1单抗的疗效。其中91%的患者有吸烟史,腺癌50%,鳞癌44%。20名患者使用Opdivo,9名患者使用Keytruda,3名患者使用Tecentriq。客观有效率28%,中位无进展时间2.3个月。9名有效患者中有3名骨转移和1名脑转移有效。然而31名患者中一共有6名肝转移,2名稳定,4名无效。
四、PD-1用药特色
1、假性进展
假性进展是指治疗初期出现原有病灶增大或出现新病灶,之后出现病灶缩小的现象。这类患者通常体感良好,肿瘤相关症状(乏力和食欲下降等)有改善。假性进展可能是免疫检查点抑制剂激活了免疫细胞,使得免疫细胞大量富集在原发病灶和微小转移灶表面或内部。
这种假性进展与治疗无效肿瘤本身发生进展在影像学上很难区别。一旦出现假性进展,因为和肿瘤复发不易鉴别,会使治疗进程受到很大干扰,如果决策错误,甚至会缩短患者的生存期。对于不同类型的癌症,假性进展发生概率并不同。假性进展在恶性黑色素瘤较为常见,而对于肺癌,发生概率只有1-3%。
因此在免疫治疗早期,影像检查出现进展,进行慎重评估非常重要。如果患者在开始免疫治疗的二个月之后出现体重下降,乏力和疼痛加重等症状,影像检查显示进展很可能就是真的进展。
2、何时停药
免疫记忆效应是免疫应答的基本原则之一,即使没有持续的刺激,肿瘤可能继续缩小或者稳定很长一段时间。如果一个患者有很好的疗效,应该用几个疗程?对于有效缓解的患者,考虑到长期治疗带来的副作用累积、输液的不便和高昂的费用,一些医生怀疑疗程超过半年甚至一年,收益是否能超过风险。如果没有明确的益处,许多患者也不愿意经常去医院。
简短的回答是,我们真的不知道。在一般情况下,药厂很少有动机花钱来设计和运行临床试验,试图确定患者减量或缩短疗程是否有同样的疗效甚至更好。他们总是希望卖出更多的药。
可以从回顾性调查结果收集有限的信息。一些治疗有效的患者可能由于副作用、保险问题,或只是厌倦了定期的治疗而停止治疗。其中的一些患者停止治疗后至少6-9个月无进展,见图8。但由于这些药物问市时间还不久,还没有足够长的时间来真正了解这些患者的稳定持续时间。我们也不知道这些患者出现进展后,重新开始免疫疗法是否可以再次有效。这种情况下,不同的医生按照不同的方法,做出最好的判断。一些患者持续治疗。一些患者人在一段固定的时间后停止它,6个月或12个月或24个月或其他一个并没有依据的时间节点。West医生的建议是:逐渐延长增加治疗的间隔时间。在6个月左右之后,从2或3周一次到4或6周一次;下一年,6-8周一次。
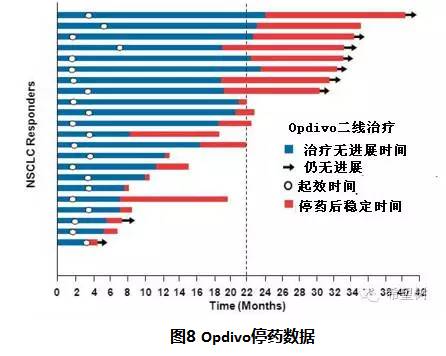
这是基于一个原则,免疫系统可能会从一个“定期刷新”的间歇治疗中获益,但每6-8周是个更合适的随访间隔时间,这降低了副作用累积的风险,同时也降低了治疗费用。然而,如果一个病人有明显的副作用或有强烈的意愿停止治疗,West医生更倾向于停药,并保持密切随访,保留再次使用免疫治疗的选项。
3、剂量调整
目前,Opdivo、Keytruda和Tecentriq的剂量均和患者的体重无关。但实际上PD-1/PD-L1抑制剂的表观分布容积和清除率与患者的体重直接相关。药厂的标准剂量是根据欧美患者的平均体重估算出来的,而中国患者的平均体重(男性66kg,女性57kg)明显低于欧美患者(美国男性89kg,女性77kg),体重较轻患者的不良反应和治疗费用将偏高。
五、肺癌种类
1、EGFR/ALK突变患者
OAK研究显示,对比多西他塞治疗组,EGFR突变亚组患者不能从Tecentriq二线治疗中获益,见图9。

Justin F Gainor回顾分析了58位接受过PD-1/PD-L1抑制剂患者的疗效,28例患者EGFR突变或ALK阳性仅1例有效,客观有效率为3.6%,而其余30位EGFR/ALK双阴患者的客观有效率为24.4%。
2、小细胞肺癌
因为小细胞肺癌与烟草致癌最为相关,且体细胞突变率最高,因此可假定小细胞肺癌患者可能会从PD-1/PD-L1免疫疗法中获益。然而小细胞肺癌肿瘤有快速生长的特性,伴发相关症状及体能状况下降,患者可能会因药物耐受不良或疾病进展而停止免疫治疗。例如在KEYNOTE 028临床试验中,147例复治小细胞肺癌筛查患者中,42例患者为PD-L1表达阳性,仅有20例接受了Keytruda治疗,客观有效率为35%,至缓解的平均时间是8.6周,缓解平均持续时间为29.1周。
CheckMate 032研究包括216名Opdivo加或不加伊匹单抗治疗在一线或多线治疗(包括一线铂类为基础的方案)后疾病发生进展的小细胞肺癌患者,其中Opdivo单药组98名,客观有效率为10%,中位随访时间为199天。
六、不良反应
OAK临床试验显示,Tecentriq最常见的不良反应(发生在20%或以上的患者)为疲劳、食欲不振、呼吸困难、咳嗽、恶心、肌肉骨骼疼痛和便秘。最常见的3-4级副作用(发生在2%的患者)为呼吸困难、肺炎、缺氧、血钠降低、疲劳、贫血、肌肉骨骼疼痛、肝脏转氨酶增高、吞咽困难和关节疼痛。和免疫相关的副作用包括肺炎、肝炎、结肠炎和甲状腺疾病。Opdivo和Keytruda的不良反应与Tecentriq类似。
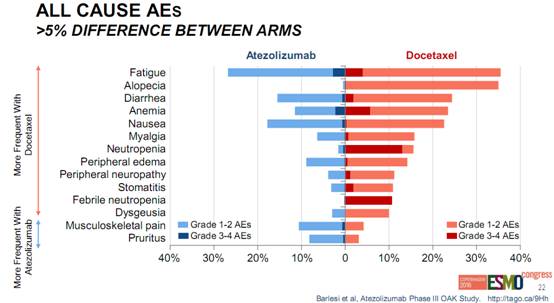
对任何怀疑免疫不良反应,排除其他原因。根据不良反应的严重程度,永久终止或不给予PD-1/PD-L1抑制剂,给予高剂量糖皮质激素(1至2 mg/kg/day泼尼松等同量),如适当,开始替代治疗。不良反应改善至1级或更低,糖皮质激素逐渐减量,历时至少1个月。根据事件严重程度考虑再重新开始PD-1/PD-L1免疫治疗。
七、肿瘤突变负荷
对肿瘤的全基因组测序发现每个肿瘤都携带有成百上千的新基因突变。这些基因突变导致产生的蛋白因为蛋白结构的改变成为新抗原。当患者接受PD-1/PD-L1抑制剂治疗后,这些新抗原可以成为一类重要的T细胞靶标。从分子角度上讲,肿瘤中携带的非同义突变的数量和这些突变导致新抗原产生的能力与接受PD-1/PD-L1免疫疗法的疗效直接相关。
肺癌患者的吸烟史与基因突变数量直接相关,因为香烟的烟雾中含有超过50种强致癌物质,长期吸烟导致肺部组织的破坏-修复循环也会积累大量的基因突变,见图10。
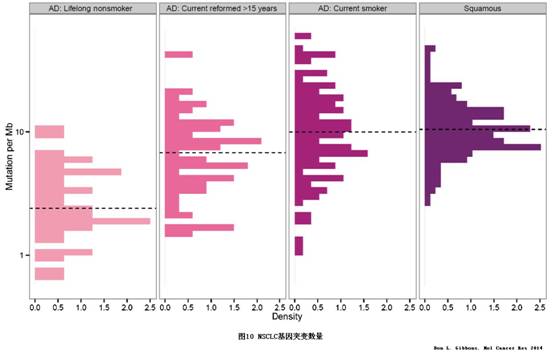
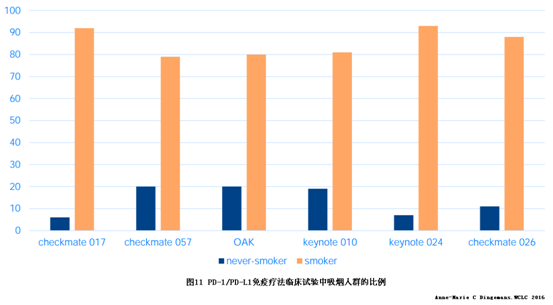
EGFR突变、HER2突变、ALK、RET和ROS1融合在不吸烟NSCLC中更为常见;BRAFV600E、TP53和KRAS突变在吸烟NSCLC中比例明显更高;MET扩增或MET 14突变与吸烟史无直接关系。PD-1/PD-L1抑制剂的NSCLC三期临床试验中绝大多数患者有吸烟史,见图11。

本文仅供医学药学专业人士阅读






.jpg-pd13)



















 X
X