-
JAMA Oncology:高剂量ES-IMRT可显著降低NSCLC患者食管炎发生率 -
Journal for ImmunoTherapy of Cancer:LAG-3抑制剂+PD-L1抑制剂或是肿瘤免疫治疗的未来 -
新药:瑞基奥仑赛第2项适应证申报上市 -
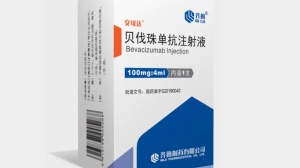
新药:国产「贝伐珠单抗」新适应证获批上市
01
JAMA Oncology:高剂量ES-IMRT可显著降低NSCLC患者食管炎发生率
02
Journal for ImmunoTherapy of Cancer:LAG-3抑制剂+PD-L1抑制剂或是肿瘤免疫治疗的未来
03
新药:瑞基奥仑赛第2项适应证申报上市
04
新药:国产「贝伐珠单抗」新适应证获批上市
点击查看全文
本文仅供医学药学专业人士阅读



.jpg-pd13)

















 X
X