历史总是惊人地相似。
我们急于战胜癌症,因为它带给我们的伤痛太多。
这也让每次有重新定义癌症治疗的创新方案出现时格外引人注意,从上个世纪的手术优化方案再到全身化疗、局部放疗,随后逐渐开始研究癌细胞,进而有基因靶向药物的出现。

1986发表在《新英格兰医学杂志》的文章抗癌进步了么?
如今最火热的是免疫治疗,同历史的每一个时期一样——这一次我们寄予它的希望依旧是“治愈”。
能让我们“续命”多久?
2017年底,距离2018年还有3天时,肿瘤杂志排名十分靠前的JAMA Oncology发表了一篇探讨“现代免疫药物能否让患者延长生存”的分析文章。
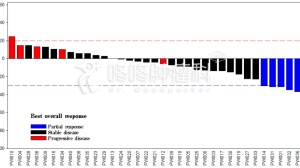
分析纳入了FDA在2011年3月至2017年8月批准的6种免疫药物(ipilimumab, pembrolizumab, nivolumab, atezolizumab, avelumab, and durvalumab ),涉及23种转移性的适应症。这些适应症获批时有10种(43%)基于生存期终点,剩余的13种基于缓解率。
分析的目的是检验这些被FDA批准的现代免疫药物,有哪种达到了ASCO价值框架的持续生存门槛。
结果显示:
-
只有3种适应症达到了“标准治疗组(对照组)生存率——20%”的门槛。
-
9种适应症达到了”对比标准治疗”所需要的提升水平——50%。
以上2个准则都符合的只有3种适应症,这3种适应症获得了ASCO框架授予的”持久生存加分”。

9种适应症符合要求:在双倍于中位生存期(OS)或无进展生存期(PFS)的节点内,使用试验(免疫)药物提升了50%以上OS或PFS,即蓝线以上。

3种适应症符合要求:对照组的患者至少有20%存活,蓝线以上。
在ASCO的评估标准中,有3个关键元素:临床获益(疗效)、毒性反应(安全性)以及成本(效率)。介于这3个元素,共有4个评分项。
-
临床研究要有生存数据(OS或PFS)
-
时间框架应当是中位生存数据的2倍
-
至少20%参与标准疗法(对照组)的患者存活
-
存活的参与测试药物(免疫组)的患者至少有50%的提升
对于这样一个不甚良好的结果,作者分析了两个原因,①大家虽然兴奋于免疫治疗可以长期延长存活期,但这种兴奋或许缺乏足够数据支撑;②ASCO的这种价值框架还不能精准评价延长持续生存获益。
为何获批的药物还能不达标?
纵然乐观主义者常把“缓解率百分比”挂在嘴边,在抗癌药物患者获益的评估中,能否”延长生存以及延长多少“仍然是个绕不过去的终极问题。
这几年,美国FDA加快了药物批准的速度,药物获批时采用“替代终点”的情况越来越多。
替代终点可以解释为不等到看研究该药物是否可以真的延长患者生命,只要达到认为可以预测临床获益的指标,如肿瘤缩小,肿瘤缩小持续时间等,就可以实现获批。
我们所知的“加速批准”采用的就是替代终点。药物以更快的获批速度,填补市场空白,政府、药厂、患者皆大欢喜。
当然,药物上市后,FDA会继续关注药物的“上市后研究”,如果没有达到试验时的患者获益,可能会要求药厂修改适应症或撤回药物获批。但事实上,撤回的过程很缓慢、艰难,因为伦理等各种原因,各方可能都不愿意撤回。
免疫疗法下”神坛”?
所以这篇文章是唱衰免疫疗法?当然不是。
免疫疗法相对其它治疗方式研究时间相对较短,进入临床的间隔更是不长。但它给了我们希望,即便只针对一小部分患者有效(现有已知的生物标志物阳性)。对于这部分人,晚期癌症达到长期持久缓解(治愈)已经实现,这是过去想都不敢想的梦境!
而对于大部分没有“已知生物标志物(阴性)”的患者,也就是无效的患者,我们能不能找到别的生物标志物?并去创造条件激活它?或许这才是免疫治疗能够实现“治愈”的关键。
交给时间回答。
本文仅供医学药学专业人士阅读







-scaled.jpg-pd13)
















 X
X