近日,一篇题关于CAR-T细胞疗法成功将一名患有横纹肌肉瘤的7岁男孩治疗康复的文章发表在Nature Communications期刊上。
CAR-T细胞疗法是通过我们自身免疫细胞消灭肿瘤细胞的新型免疫治疗方式。

图1 文章发表在Nature Communications
横纹肌肉瘤(RMS)是儿童和青少年最常见的恶性软组织肿瘤。
而对于转移性横纹肌肉瘤的患者,传统化疗的疗效有限,且缺乏更有效的治疗手段。那么CAT-T细胞疗法能否成为治疗的希望呢?
CAR-T疗法是嵌合抗原受体T细胞免疫疗法,英文全称Chimeric Antigen Receptor T-Cell Immunotherapy,是一种新型的精准靶向疗法,通过我们自身的免疫细胞来杀死癌细胞的免疫治疗。
这种治疗方式在白血病和淋巴瘤治疗上应用,且疗效显著,但在实体肿瘤的治疗进展较慢,其主要原因是实体肿瘤的异质性较强。
CAR-T疗法的治疗步骤:
提取
改造
回输
在这篇文章中,临床研究的对象是一名已经扩散到骨髓的横纹肌肉瘤7岁患病儿童。因标准化疗方案的治疗效果不佳,成为了接受新型CAR-T细胞疗法的候选对象。通过检测,儿童大约75%的肿瘤细胞表面显示出一种HER2蛋白。
研究人员就针对之一蛋白,对T细胞进行基因改造,使T细胞成为能够识别HER2阳性的CAR-T细胞,从而靶向HER2蛋白进行治疗。

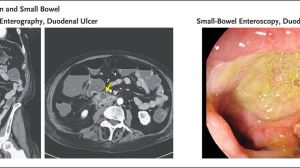
图2 患儿入组前的临床和病理检查结果及CAR-T细胞输注方案
患儿诊治过程
患儿的双侧骨髓穿刺活检(BMAB)经苏木精-伊红染色发现有肺泡型横纹肌肉瘤(RBS)细胞浸润,及对结蛋白和肌生长素的免疫反应(图2a)。
经PET-CT显示广泛BM受累(上面板)和右小腿原发肿瘤(下面板)(图2b)。
原发肿瘤的手术切除,证实了RMS的诊断(图2c)。
肿瘤DNA测序检测到PIK3CAQ546R的体细胞变异,对该儿童完成了为期13个月的全身化疗,并对原发部位进行了放射治疗,疾病得到控制后再次进展。
免疫组化(图2d)证实原发肿瘤和骨髓转移瘤上HER2表面表达后,该儿童被纳入HER2 CAR-T细胞的I期试验。
为逆转录病毒载体转导引入的HER2CAR转基因成分示意图(图1e)。研究人员制造了HER2 CAR-T细胞,并包含具有效应器记忆特征的CD8+T细胞。
经检测,在72.9%的患者T细胞中检测到基于FRP5抗体的HER2特异性CAR分子,该分子含有CD28共刺激性内域(图2f)。
治疗方案包括诱导期和巩固期。
经挽救化疗四周后,先接受了三周期的HER-2 CAR-T细胞诱导治疗,期间每隔10周进行环磷酰胺/氟达拉滨化疗淋巴结清扫,诱导期结束时,患儿没有再出现RMS的形态学和影像学证据。
之后又进行了四周期无淋巴结清扫的CAR-T细胞巩固治疗(图2g)。

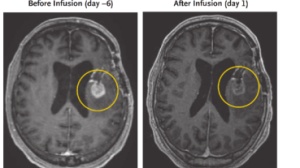
图3 HER2 CAR-T细胞输注后的临床和病理结果
患儿的治疗效果得到了令人振奋的效果。在经过靶向HER2蛋白的CAR-T细胞治疗三周期后,PET-CT显示患者骨髓及其他部位肿瘤消失。(图3c)
但在停止T细胞输注6个月之后,癌症在骨髓中复发了。幸运的是,对患儿再次进行了一周期的去淋巴结化疗和HER2 CAR-T细胞治疗后,疾病实现了第二次缓解。
为了巩固疗效,在第二次缓解后还进行了额外的CAR-T细胞联合PD-1抗体治疗(帕博利珠单抗)(图4e)。
截止文章发布时,患者已经20个月没有接受CAT-T细胞治疗,疾病没有复发。

图4 复发后HER2 CAT-T细胞回输及二次缓解期间检测
病例启示
这项研究通过增强自身HER2CAR-T细胞的持续性扩增,安全有效的使难治性转移横纹肌肉瘤患儿得到了持久的疾病缓解。
同时,这项令人惊讶的研究结果为接下来的研究提供了重要启示:
首先,在这项研究之前,一项HEROS临床研究中已经发现,靶向HER2+肿瘤细胞的CAR-T细胞具有良好的安全性,且在一小部分患者中起效。但由于靶向HER2 CAR-T细胞没有持续存在,所以这种治疗方式并没有根除肿瘤。
而在此次被称为HEROS2.0的临床研究中,对患者连续进行了持续的HER2 CAR-T细胞的输注和低剂量的化疗,使HER2 CAR-T细胞持久存在和增殖。同时,在进行输注HER2 CAR-T细胞前,对患者进行了淋巴细胞消除化疗,去除了患者体内现存的免疫细胞,为经过基因改造的CAR-T细胞在患者体内增殖创造了空间。
再者,在儿童体内并非所有癌细胞表面均HER-2阳性,但却肿瘤却完全消失了。
这就让我们思考,既然HER-2 CAR-T细胞靶向识别和消灭HER-2阳性的肿瘤细胞,那么那些HER-2阴性的肿瘤细胞是怎么消失的呢?
研究人员分析其原因是:输注HER2特异性CAR-T细胞后,患者自身的免疫系统被招募起来对抗肿瘤细胞,因此达到了持久的完全缓解的效果。这一推断需要大量的接受HER2 CAR-T细胞治疗的临床研究证实。
另外,在对儿童的免疫球蛋白(IgG)水平监测发现,在诱导过程中反常地显示出增加的趋势(图5a)。
同时患儿血清对不同稀释度的FUT8、USP2和RAB7B的反应性,也证实了针对GSK3α(PI3K/AKT信号通路的下游靶点)的明显输注后自身抗体反应。
这说明,CAR-T细胞治疗的途径是增强T细胞和增强内源性免疫反应因子两种方式,同时也可能包括那些与肿瘤侵袭和转移的因子(如FUT8和USP2)。

图5 患儿输注CAR-T细胞前后血清中的自身抗体反应
同时,研究发现,反复输注CAR-T细胞所产生的炎症环境可能与表达CAR的CD8+细胞毒性T细胞的免疫调节受体PD-1和LAG3上调有关。
帕博利珠单抗与CAR-T细胞结合是否可以改善CAR-T细胞功能,仍需要进一步探究。在联合治疗期间,我们观察到血清中Th2细胞因子IL-6和IL-4水平升高,其来源和意义也需要在其他患者中进行评估。
小结
近几年,CAR-T细胞疗法通过对T细胞的基因改造,在白血病和淋巴瘤治疗等领域取得令人振奋的效果,是一种精准高效的治疗方式。
此次的报道,也增加了我们对实体肿瘤的治疗的信心。
Hegde博士表示,他们计划在更多接受HER2CAR-T细胞治疗的患者中进行更详细的实验,以更好的了解患者免疫系统在消除癌症中的作用。
CAR-T的抗肿瘤作用及针对非靶向蛋白的内源性免疫应答在控制肿瘤的潜在作用也需要更多研究支持。随着研究的进展,CAR-T细胞疗效将有可能治愈癌症的新型肿瘤免疫治疗方法。
参考文献:
Meenakshi Hegde,et al.Tumor response and endogenous immune reactivity after administration of HER2 CAR T cells in a child with metastatic rhabdomyosarcoma.Nature Communication,2020,doi:10.1038/s41467-020-17175-8
本文仅供医学药学专业人士阅读




















 X
X