2017年,Kymriah与Yescarta的获批上市宣告了CAR-T疗法时代的到来,也让我们看到了基因编辑与细胞疗法的无限潜力。昨日,一篇发表在《自然》期刊上的研究,则有望进一步加快细胞疗法的研发进程。业内诸多专家们表示,这可能会给细胞疗法领域带来重大变革。

目前上市的两款CAR-T疗法,其使用的基因编辑技术均依赖于病毒载体。这是对病毒的一次成功改造——很久以前我们就知道,病毒的遗传物质能穿透细胞膜,进入到细胞内,引起感染。这个特性引起了科学家们的兴趣。在1970年代,“生物黑客”们移除了病毒中的致病部分,将它们改造成了递送遗传物质的工具。“病毒载体”一词也由此诞生。如今,这些病毒在基因疗法和细胞疗法中得到了广泛的应用。
▲目前获批的CAR-T疗法,使用的都是基于病毒载体的编辑技术(图片来源:诺华官方网站)
尽管基于病毒载体的先进疗法在研发上取得了诸多突破和进展,也让我们看到了创新基因疗法和细胞疗法井喷的希望,但病毒载体本身却有着成本高、周期长的瓶颈。此外,单靠病毒载体也无法将基因精准地插入到所需的位置,能带来潜在风险——它们可能会影响到健康基因的表达,或是导致插入基因被异常调节,出现失控。这些风险都是高悬于病毒载体头上的达克摩利斯之剑,使我们在基因疗法和细胞疗法的研发上不得不慎之又慎。
“人们花了30年的时间,想要把基因转入到T细胞中。”该研究的第一作者,正在攻读MD/PhD学位的Theo Roth说道。他指出,为了开发用于T细胞编辑的病毒载体,即便有6-7名科学家辛勤工作,也要花上约数月,甚至是一年来进行开发。如果能找到一种不使用病毒载体,但依然能对细胞进行有效编辑的方法,无疑将极大地加速先进疗法的开发。这对整个领域而言,可能带来革命性的变化。

▲本研究的第一作者Theo Roth(图片来源:UCSF)
而本篇《自然》上公布的方法看起来简单得不可思议:谁也没有想到,几十年前就在微生物研究中大放异彩的电穿孔技术(electroporation),竟能在细胞疗法的开发上焕发光彩。
许多看似简单的成果背后,往往有着常人难以想象的枯燥工作,这项研究也不例外。尽管在几十年前,我们就在微生物中尝试了电穿孔方法来引入外源DNA,但这种方法先前尚未在细胞疗法里得到广泛应用,不是没有原因的。
在电穿孔技术中,研究人员们会给细胞施加一个电场,瞬间增加细胞膜的通透性,让双链DNA进入细胞。但在T细胞内,一旦引入较长的双链DNA片段,竟会导致这些细胞的死亡。在经过大量的尝试后,许多科学家们都放弃了这个挑战。他们认为,较长的双链DNA会对T细胞产生毒性。相比之下,引入单链寡核苷酸则更具可行性。
但Theo则不信这个邪。从之前的一些研究结果中,他敏锐地观察到,如果在电穿孔技术中同时应用CRISPR-Cas9系统与双链DNA模板,就有望能减少双链DNA相关的细胞毒性。这给他的研究带来了突破口,也带来了更多的问题:CRISPR和DNA的最佳比例是多少?DNA的质量需要多高?这些T细胞需要特殊培养吗?电穿孔所使用的电流强度是多少?只有各个条件都得到了优化,我们才能有效地使用这种简便的方法,去改造T细胞。
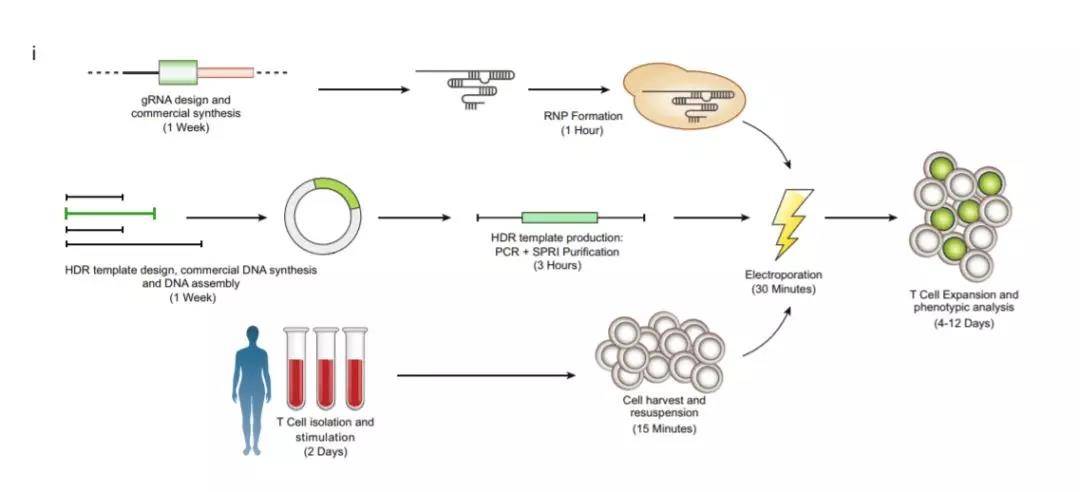
▲数千次的失败,才带来了这套完善的改造流程(图片来源:《自然》)
除了挨个尝试之外,Theo没有其他选择。
该研究的负责人Alexander Marson教授认为,Theo的坚守对成功至关重要。尽管主流学界都相信T细胞只能耐受小片段的DNA,都相信病毒载体不可或缺,但Theo不惧权威,“展现出了海格力斯般的努力,测试了数千种不同的条件”。
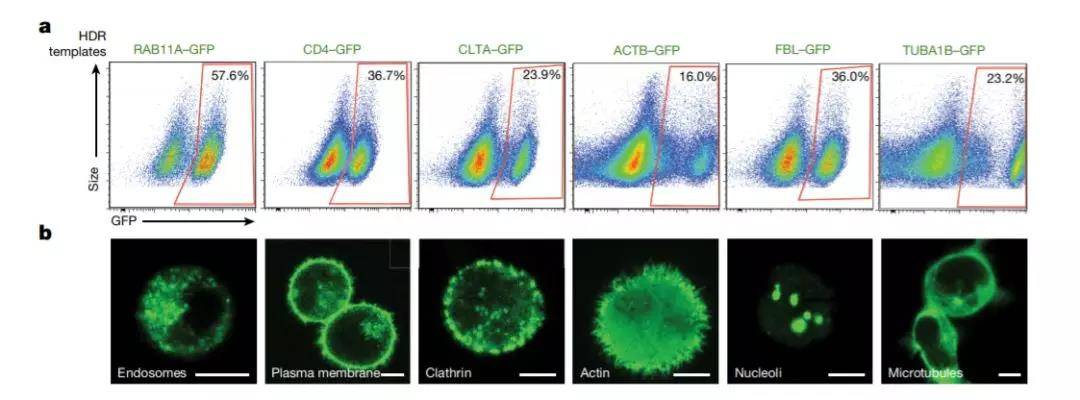
▲利用这套系统,研究人员们可以“随心所欲”地将绿色荧光蛋白表达于细胞的不同部位(图片来源:《自然》)
成功建立在数千次失败之上。经过近一年的反复尝试,Theo终于总结出了一套行之有效的方法,并成功证明这套不使用病毒载体的系统,能成功对基因组进行高效编辑。在概念验证性的实验中,这支团队成功让绿色荧光蛋白按照需求,在细胞核、细胞膜、细胞骨架、以及细胞器中特异表达。
更令人印象深刻的是,这套系统能将原来需要花费数月甚至数年的工作,缩短到仅仅几周!
为了进一步验证这套系统的潜力,研究人员们又做了两个实验。在第一个实验中,他们从罹患罕见自身免疫疾病的患者中取得了T细胞。基因组测序结果表明,这些T细胞的IL2RA基因带有突变,让它无法行使正常功能。因此,患者体内的调节性T细胞会出现发育异常,无法有效地控制免疫系统,从而让它对自身展开攻击。
利用他们开发的新型技术,这群科学家们快速地修复了T细胞中的IL2RA基因缺陷,重塑关键的细胞通路。出于安全性上的考虑,研究人员们没有将经改造的细胞输注回患者体内。但类似于CAR-T疗法,未来,我们有望在体外修正患者的T细胞,并在扩增之后,重新输注给患者,治疗他们的自身免疫疾病。

▲经过这套系统改造的T细胞能特异性聚集在肿瘤附近,且与病毒载体改造的细胞有类似的效率(图片来源:《自然》)
在第二项研究中,科学家们则把目光投向了癌症的治疗。他们从健康人体内获取了T细胞,并更换了它们的T细胞受体,使这些细胞能特异性地攻击某种人类的黑色素瘤细胞。在培养皿中,这些T细胞能有效地靶向黑色素瘤细胞,而不会识别其他类型的细胞,表明了其特异性。而在小鼠的肿瘤模型里,这些具有全新受体的T细胞也同样能聚集在肿瘤位点,展现出抗癌的活性。
“这是一种快速、灵活的方法,能对T细胞进行改造、增强、以及重编程,使我们能赋予这些细胞各种特异性,用来摧毁肿瘤,识别感染,或是减少它们的免疫反应,治疗自身免疫疾病,” Marson教授补充道:“现在,我们参与到了所有的前沿领域中。”
这项成本更低,且能在短短数周内完成自定义T细胞改造的方法,得到了许多业内专家的看好。如果它能在细胞疗法的开发上得到更多应用,无疑将有潜力改变当下的研发格局。近期,美国FDA出台了一系列针对基因疗法和细胞疗法的政策,鼓励这些先进疗法的研发。我们期待在这个激励创新的大环境下,更多突破性的技术能得到转化,为全球患者带来更多有效疗法。
参考资料:
[1] Reprogramming human T cell function and specificity with non-viral genome targeting
[2] T cell engineering breakthrough sidesteps need for viruses in gene-editing
[3] Electroporation – 维基百科
[4] Parker Institute scientists herald a cell therapy breakthrough in the lab, using next-gen CRISPR tech to engineer T cells
[5] Virus-free CRISPR could mean faster, more precise gene editing for T-cell therapies
本文仅供医学药学专业人士阅读



















 X
X