免疫治疗已成为肝细胞癌综合治疗不可或缺的一部分。免疫疗法已被证明对早期HCC、晚期HCC或肝移植后HCC复发的患者有效。临床上,最常用的免疫治疗是使用CTLA-4和PD-1等单克隆抗体的免疫检查点抑制。然而,它并不能从根本上解决在杀死肿瘤细胞时免疫系统减弱和免疫细胞失活的问题。
T细胞通过基因编辑在细胞表面表达肿瘤抗原识别T细胞受体(TCRs)或嵌合抗原受体(CARs),提高免疫细胞的特异性和应答性。根据以往的研究,TCR-T细胞治疗在实体肿瘤的治疗上明显优于CAR-T细胞治疗,是目前最有前途的实体肿瘤免疫细胞治疗方法之一。无独有偶,在今年的ASCO会议上就报道了TCR-T细胞治疗难治滑膜肉瘤患者和粘液样/圆细胞脂肪肉瘤(MRCLS)患者的疗效和安全性。结果显示,滑膜肉瘤患者的总缓解率达到了41.4%,疾病控制率达到了86.2%。
在目前的TCR-T细胞治疗中,以肿瘤睾丸抗原(cancer testosterone antigen, CT)为靶点的TCR-T细胞是最常用的。CT可在多种肿瘤组织中表达,但在除睾丸、胎盘和胎儿卵巢外的正常组织中不表达。由于其独特的表达,已成为肿瘤免疫治疗的理想靶抗原。最常用的抗原靶点是NY-ESO-1。NY-ESO-1抗原在各种肿瘤中的表达频率不同,蛋白表达频率也不同。NY-ESO-1 mRNA在前列腺癌、膀胱癌、乳腺癌、多发性骨髓瘤和肝细胞癌中高表达,在口腔鳞状细胞癌和食管癌中低表达。2011年,首次报道了针对NYESO-1的TCR-T细胞治疗对黑色素瘤和滑膜肉瘤都有效。
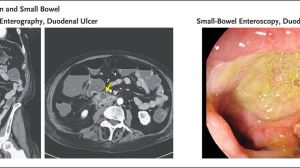
肝癌首个TCR-T细胞疗法旗开得胜,1例患者达CR!
ADP-A2AFP研究采用的是特有的TCR-T(T细胞受体-T细胞)技术平台SPEAR(特定肽增强亲和力受体)T细胞治疗技术。这是一项首次在人体内进行的开放性研究,采用改良的3+3设计,目标剂量逐渐增加:1亿(队列1),10亿(队列2)和12-60亿(队列3)转导SPEAR T细胞以评估安全性,包括剂量限制毒性(DLT)。
ADP-A2AFP研究共纳入了9例晚期肝细胞癌患者,这些患者都是手术后接受局部治疗,失败或不耐受,临床上没有标准治疗方案的晚期患者。9名患者分别接受了不同剂量的新型TCR-T技术–SPEAR(特定肽增强亲和力受体)T细胞治疗,其中队列1为2例,队列2和队列3均为3例,剂量扩展组1例。
在队列1和队列2中,分别对5例患者进行了1亿和10亿个转导细胞剂量的治疗,所有患者的最佳反应均为SD。队列2中的一例患者在治疗一个月后原发病灶体积未缩小,但纵膈淋巴结转移灶体积明显缩小!
而队列3中的研究结果则作为口头报告出现在2020 ILA大会上。截至2020年2月10日,在第3队列中,3名患者(1 M, 2 F)接受了56亿、50亿和51亿个转导细胞的治疗。
患者出现细胞减少(G4白细胞减少、淋巴细胞减少和中性粒细胞减少),以及与淋巴消耗化疗相关的发热性中性粒细胞减少,随后恢复。未见T细胞相关肝毒性的报道,但有1例患者出现肝化学异常,可能与ADP-A2AFP有关,目前正在评估中。到目前为止没有DLT的报告。3例患者中,1例患者出现血清AFP持续降低,并且完全缓解(CR),另外两例患者疾病进展,但AFP水平均有下降。
目前还没有T细胞相关的靶向或脱靶毒性的明确报告,也没有协议定义的DLT出现。总体而言,接受低剂量治疗的患者最佳反应是病情稳定;在接受最高剂量的4名患者中一名患者获得完全缓解,并已持续6个月以上,这位患者在治疗前外周血AFP水平很高,经治疗后明显下降并恢复正常,这些数据也支持继续研究。目前,已有6个TCR-T细胞疗法治疗HCC的临床试验正在进行中。我们也期待能有更多新的治疗方案造福更多患者。
参考来源
Reference
1、Lu F, Ma X-J-N, Jin W-L, Luo Y and Li X (2021) Neoantigen Specific T Cells Derived From T Cell-Derived Induced Pluripotent Stem Cells for the Treatment of Hepatocellular Carcinoma: Potential and Challenges. Front. Immunol. 12:690565.
2、Sangro B, Borad MJ, Hausner PF, et al. Data from the third dose cohort of an ongoing study with ADP-A2AFP SPEAR T cells. Presented at: 2020 Digital International Liver Congress; August 27-29, 2020; Virtual. Abstract LBO12.
本文仅供医学药学专业人士阅读












-scaled.jpg-pd13)
















 X
X