文章来源:与爱共舞订阅号

文. 许柯
近日,我们收到了一个重磅喜讯:CAR-T疗法即将在国内获批上市。
根据国家药品监督管理局(NMPA)官网消息,国内企业复星凯特的CAR-T产品阿基仑赛注射液的上市申请已进入行政审批阶段,审批工作已接近尾声,最快将在2-3月获批上市。
此次阿基仑赛注射液的上市申请是基于在中国开展的一项单臂、开放性、多中心桥接临床试验(FKC876-2018-001),在难治性侵袭性 NHL(大B细胞淋巴瘤)中国患者中评估了本品的安全性和疗效。

阿基仑赛注射液药品注册进度已更改为在审批
图片来源:国家药品监督管理局药品审评中心官网
如果一切顺利,就意味着我国将有首款CAR-T治疗产品,也意味着国内的肿瘤患者将再添一种全新的治疗选择。
什么是CAR-T?
虽然CAR-T疗法已经不是什么新鲜的事物,但相信还是有很多患友对其缺乏了解,这里就先为大家介绍一下这种新型的免疫疗法。
故事要先从一个名为Emily Whitehead的小女孩说起。
2012年4月,当时仅有7岁的Emily在经历过急性淋巴性白血病两次复发后,命悬一线。当时市面上传统的治疗方法已经无济于事,但Emily的父母并未放弃希望,他们让Emily加入了一个I期临床项目进行治疗,由此Emily成为世界上首位接受 CAR-T癌症免疫疗法的孩子。
在接受了CAR-T疗法的治疗后,Emily的症状迅速好转,仅3周时间骨髓检测结果就转为阴性,Emily体内的癌细胞被彻底杀死。直至今天Emily的白血病也再没有复发过。

Emily治愈1年后和8年后的照片
而这种可以将癌症治愈的神奇疗法也因此得到了广泛的关注。
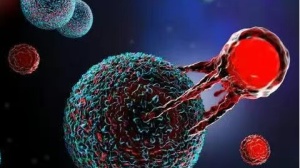
CAR-T全称是嵌合抗原受体T细胞免疫疗法。其原理是将嵌合抗原受体(CAR)导入T细胞内,使T细胞可以识别癌细胞,从而利用免疫系统消灭癌细胞。
即,CAR-T=CAR+T细胞。
我们都知道T细胞是我们体内的免疫卫士,它可以直接消灭我们体内的肿瘤细胞,是我们通过自身免疫对抗肿瘤的重要帮手。但是狡猾的癌细胞往往会采用一些方法来逃脱T细胞的追捕,这时我们就需要重新让T细胞找到癌细胞。
将嵌合抗原受体(CAR)导入T细胞后,形成的CAR-T细胞就可以特异性的识别肿瘤细胞,从而一举将其消灭。

CAR-T细胞作用机理
CAR-T临床应用一般包括5个步骤:
1. 采集
通过一个特殊的机器,将患者血液中的T细胞提取出来,再将血液回输。
2. 改造
利用基因工程技术将采集到的T细胞导入嵌合抗原受体(CAR),形成可特异性识别肿瘤细胞的CAR-T细胞。
3. 增殖
将CAR-T细胞进行培育增殖,按每公斤体重计算所需剂量,一般需几十亿至上百亿个。
4. 清髓
对患者进行诸如化疗的清髓治疗,以便清除免疫抑制细胞,且可以减少肿瘤负荷,从而增强疗效。
5. 输注
接受过化疗的患者,将接受CAR-T细胞的输注,让CAR-T细胞重新进入患者的血液之中发挥免疫作用。
接受了CAR-T治疗的患者有70-90%的可能会出现细胞因子释放综合征,即如同感冒一样的高烧、疲劳和身体疼痛,但一般会持续5-7天。因此患者在治疗后还需住院1-3周观察后续副反应的情况,并在出院后的几个月里进行定期随访。
CAR-T疗法的治疗效果
CAR-T细胞疗法作为目前肿瘤治疗领域的大热门自然是博得了众多医药公司以及投资者的青睐。截至2020年6月,共有357个CAR-T研究实验在我国展开,有256个在美国展开,而其他国家的研究仅有58个。可见CAR-T研究领域在我国是绝对的热门项目。

全球CAR-T临床试验数量情况
那么大规模的研究以及大量资金的注入能为CAR-T研究带来了什么呢?
血液肿瘤
CAR-T疗法最早就应用于血液肿瘤的治疗,并且在血液肿瘤的治疗领域取得了不错的成果。随着技术的不断发展,CAR-T在血液肿瘤的治疗之路上可谓是越走越顺。
2020年欧洲医学肿瘤学会(ESMO2020)上公布了一款双特异性CAR-T产品AUTO3的临床研究数据。
该研究针对复发性、难治性、弥漫性大B细胞淋巴瘤,其客观缓解率为68%,完全缓解率为54%,达到完全缓解的患者中有93%未复发。
2020年美国临床肿瘤学会年会(ASCO2020)上公布了一项Ib/II期CARTITUDE-1临床研究的最新数据,JNJ-4528(一种研究性B细胞成熟抗原介导的CAR-T疗法)用于治疗复发或难治性多发性骨髓瘤,其客观缓解率高达100%,其中完全缓解率为76%,部分缓解率为3%。
实体肿瘤
相较于血液肿瘤,CAR-T疗法用于实体肿瘤存在以下难点:
实体肿瘤体积大、肿瘤微环境复杂且存在大量免疫抑制因子、肿瘤抗原靶点多种多样且不断变异、CAR-T细胞很难浸润至肿瘤组织、实体瘤中多种免疫逃逸机制等。
近年来随着研究的不断深入,CAR-T疗法还是在实体肿瘤治疗上有所斩获。
宾夕法尼亚大学佩雷尔曼医学院等机构的研究人员研究发现,将CAR-T疗法与PAK4抑制剂药物相结合能促进工程化细胞攻击肿瘤。
接受该治疗方法的胶质母细胞瘤小鼠,肿瘤生长减少了近80%,生存时间也有明显的延长。

PAK4抑制使GBM对CAR-T免疫疗法产生敏感性
这说明通过PAK3抑制剂来重编程整个血管微环境从而促进并改善癌症的细胞治疗。
该方法除可用于脑肿瘤外还可用于乳腺癌、胰腺癌等多种实体肿瘤的治疗。
美国的一项实验发现溶瘤病毒和CAR-T的联合疗法根除了单独使用CAR-T无法治疗的实体肿瘤。

溶瘤病毒促进CAR-T细胞的肿瘤浸润
但相较于在血液肿瘤领域的成熟应用,CAR-T在实体肿瘤治疗方向还有漫长的路要走。但这并不妨碍我们对CAR-T疗法怀有足够的期待。
CAR-T疗法发展至今已经出现了4代的产品,每一代结构都是在各个细节上突破,使CAR-T往更为精准、更为高效、更为持久的方向发展。
如今更多靶点的开发,更多联合治疗方案的提出都在为CAR-T更多的临床应用铺平道路,相信CAR-T未来的肿瘤治疗之路会更加光明。
国内CAR-T上市的影响
再重新说回到国内首款CAR-T的上市。
如果阿基仑赛注射液获批上市,首先对符合其适应症的患者而言又增加了一种新的治疗选择,也就多了一份希望。
其次,这第一道大门的打开意味着CAR-T疗法已经被国内环境所接纳,未来更多CAR-T产品或适应症的研发及审批都将得到提速。
当然,对于患者而言最关心的还是价格。
由于研发投入多,治疗高度个性化,药品及耗材成本高昂等问题导致CAR-T的治疗花费相当惊人。
目前,已上市的CAR-T产品的治疗花费折合成人民币均在百万以上,这对于患者而言是很难接受的“天价”。
国产CAR-T的定价虽然会显著低于国外的价格,但是可以让大部分患者接纳仍是未知数。不过通过国产化耗材等方法治疗价格还是有下降的余地。
我们希望好的治疗方式可以惠及更多需要它的人,也希望更多的治疗方法可以帮助那些需要帮助的人。
总之,国内CAR-T的上市将仅仅只是一个开始。
参考文献: [1] Phase I Alexander study of AUTO3, the first CD19/22 dual targeting CAR.T cell, with pembrolizumab in patients with relapsed/refractory (r/r) DLBCL.(2020ESMO/890MO) [2] Update of CARTITUDE-1: A phase Ib/II study of JNJ-4528, aB-cell maturation antigen (BCMA)-directed CAR-T-cell therapy, inrelapsed/refractory multiple myeloma. (abs 8505 ) [3] doi:10.1038/s43018-020-00147-8 [4] doi:10.1038/s41591-020-1039-5 [5] https://www.nmpa.gov.cn/
本文仅供医学药学专业人士阅读



.jpg-pd13)

.jpg-pd13)


.jpg-pd13)
-1.jpg-pd13)














 X
X