
程序性死亡 1(PD-1)抑制剂在过去一年风光无限,接连获得美国 FDA 批准治疗多种癌症(肺癌、黑色素瘤等)。作为当前备受瞩目的治疗方法——免疫治疗,PD-1 抑制剂的应用前景显示出巨大潜力。
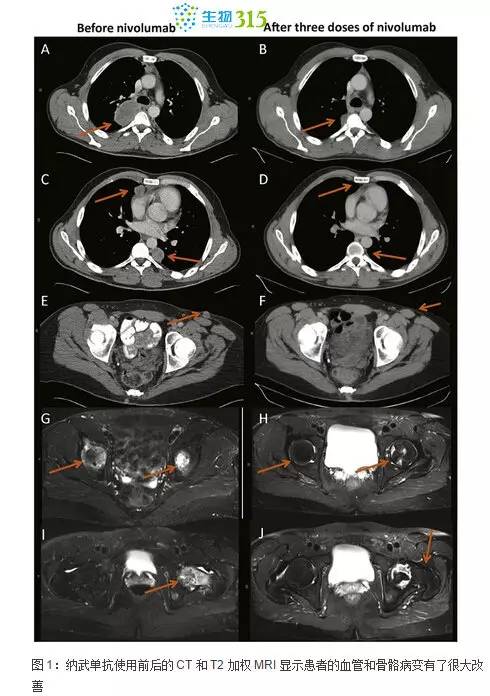
三个剂量的纳武单抗使用后,患者血红蛋白从 10.5 g/dl 上升至 14.3 g/dl,血小板数从 489 k/ml 降至 190 k/ml,C 反应蛋白从 2014 年 10 月的 67.8 mg/dl 降至 0.7 mg/dl。纳武单抗使用前后的 MRI 和 CT 检查结果也显示肺部、皮下以及骨骼的病变有了很大改善(图 1)。到目前为止,患者未出现纳武单抗相关的不良反应。
目前肿瘤的免疫治疗正在迅速发展,有望改变各种肿瘤的治疗现状。对于 RCC,单药或联合使用免疫检查点抑制剂的相关实验已经有了很大进展并且结果很好。重要的是,迄今为止所有的有关 RCC 的免疫检查点抑制剂实验均要求至少有一些透明细胞成分作为纳入标准,对于非透明细胞(NCC)组织则被排除在外。
该患者检查还发现 PBRM1 突变。PBRM1 是一个抑癌基因,大约有 40-50% 的透明细胞 RCCs 会出现此突变,但在乳头状 RCC 中突变率仅为 3%。因此,尽管未发现 VHL 突变,也未发现对 VEGF 抑制剂敏感,患者的组织学仍然可能为透明细胞 RCC 而不是乳头状 RCC。然而,该患者不符合目前任一临床实验的纳入标准,并且乳头状的组织病理学是经过两个独立的机构确认的。
先前的来自 50 名乳头状 RCC 患者的肿瘤样本分析显示,根据检测的是肿瘤细胞还是免疫浸润细胞的不同,PD-1 配体(PD-L1)的阳性率在 10%-60% 之间。其他 NCC 亚型如嫌色细胞型和 Xp11.2 易位型也表达 PD-L1。在透明细胞 RCC 和其他肿瘤类型中,尽管 PD-L1 阳性率并不是一个非常有意义的指标,但它可能预示着患者可从抗 PD-1 治疗中获益更多。
鉴于 NCC RCC 中 PD-L1 中的表达以及临床观察结果,未来的免疫检查点抑制剂试验应该包括 NCC RCC 和其他侵袭性高的如肉瘤样去分化或者杆状的肿瘤。在这一过渡时期,对于 NCC RCC 患者,如果没有其他好的选择,可以考虑抗 PD-1 治疗。
(来源:丁香园)
本文仅供医学药学专业人士阅读






.jpg-pd13)
.jpg-pd13)




.jpg-pd13)













 X
X